Справедлив ли для электронов
Закон Ома?
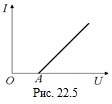 При постоянной температуре графиком, выражающим зависимость силы тока от напряжения (вольт-амперная характеристика) для растворов электролитов, является, как и для металлического проводника, прямая линия. Однако эта прямая не проходит через начало координат, а «сдвинута» вправо (рис. 22.5). Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита. Дело в том, что в процессе электролиза электроды покрываются слоями газов: катод – водородом, а анод – кислородом, что приводит к возникновению дополнительной ЭДС – ЭДС поляризации. Причем ЭДС поляризации õр имеет знак, противоположный знаку напряжения U на электродах. На рис. 22.5 отрезок ОА соответствует ЭДС поляризации.
При постоянной температуре графиком, выражающим зависимость силы тока от напряжения (вольт-амперная характеристика) для растворов электролитов, является, как и для металлического проводника, прямая линия. Однако эта прямая не проходит через начало координат, а «сдвинута» вправо (рис. 22.5). Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита. Дело в том, что в процессе электролиза электроды покрываются слоями газов: катод – водородом, а анод – кислородом, что приводит к возникновению дополнительной ЭДС – ЭДС поляризации. Причем ЭДС поляризации õр имеет знак, противоположный знаку напряжения U на электродах. На рис. 22.5 отрезок ОА соответствует ЭДС поляризации.
СТОП! Решите самостоятельно: В15, В16, D1.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Задачи легкие
А1. Чистая дистиллированная вода и поваренная соль являются изоляторами. Почему же раствор соли в воде является проводником?
А2. При электролизе выделенные из раствора ионы металлов переходят, теряя заряд, на катод. Каким образом пополняется количество ионов металлов в растворе?
А3.Цинковый анод массы т = 5,0 г поставлен в электролитическую ванну, через которую проходит ток I = 2,0 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка k = 3,4×10–7 кг/Кл.
A4.Найти массы веществ, выделившихся за время t = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах – медный, никелевый и серебряный – опущены соответственно в растворы CuSO4, NiSO4 и AgNO3. Плотность тока при электролизе I = 40 А/м2, площадь катода в каждой ванне S = 500 см2. Электрохимические эквиваленты меди, никеля и серебра: k1 = 3,3×10–7 кг/Кл, k2 = 3×10–7 кг/Кл и k3 = 11,18×10–7 кг/Кл.
А5. Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5 А. Какую поправку надо внести в показание амперметра, если за время t = 10 мин на катоде отложилась масса меди m = 0,316 г? Электрохимический эквивалент меди k = 3,3×10–7 кг/Кл.
А6. Двеодинаковые электролитические ванны соединены между собой последовательно. В одной из них – раствор CuCl, в другой – СuС12. В какой из ванн на катоде меди выделится больше?
А7. На что нужно больше ампер-часов: на выделение одного моля меди из раствора CuSO4 или на выделение одного моля железа из раствора FeCl2?
А8. Найти электрохимический эквивалент натрия. Молярная масса натрия m = 0,0230 кг/моль, его валентность z = 1. Постоянная Фарадея F = = 9,65×104 Кл/моль.
А9.Сколько кулонов электричества должно пройти через электролит, чтобы из него выделился киломоль одновалентного вещества?
А10. Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота т = 5 г. Молярная масса золота m = 0,066 кг/моль.
А11.При электролитическом способе получения никеля на единицу массы расходуется Wт = 10,0 кВт×ч/кг электроэнергии. Электрохимический эквивалент никеля k = 1,08×10–3 кг/(А×ч). При каком напряжении производится электролиз?
А12.При электролитическом способе получения алюминия на единицу массы расходуется W1т = 50 кВт×ч/кг электроэнергии. Электролиз проводится при напряжении U1= 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении U2 = 8,1 В?
Дата добавления: 2016-04-11; просмотров: 1845;
