Теплоемкость газа при постоянном объеме
Одноатомный газ. Пусть n молей одноатомного газа находятся при температуре Т, тогда его внутренняя энергия равна 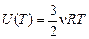 . Повысим температуру Т на DТ при постоянном объеме, тогда его внутренняя энергия будет
. Повысим температуру Т на DТ при постоянном объеме, тогда его внутренняя энергия будет  . Изменение внутренней энергии составит
. Изменение внутренней энергии составит
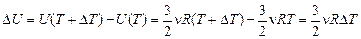 .
.
Работа газа при этом равна DА = рDV = 0, так как V = const; DQ = DU + DA = 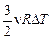 . Тогда теплоемкость газа при постоянном объеме
. Тогда теплоемкость газа при постоянном объеме 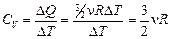 . Итак:
. Итак:
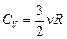 . (11.4)
. (11.4)
Заметим, что СV не зависит от того, какой это газ.
Молярная теплоемкость 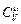 (теплоемкость одного моля) газа согласно формуле (11.3)
(теплоемкость одного моля) газа согласно формуле (11.3) 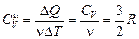 – одинаковая величина для всех одноатомных газов. Итак:
– одинаковая величина для всех одноатомных газов. Итак:
 . (11.5)
. (11.5)
Вычислим значение молярной теплоемкости:
 Дж/(моль×К) » 12,5 Дж/(моль×К).
Дж/(моль×К) » 12,5 Дж/(моль×К).
Удельная теплоемкость 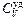 (теплоемкость 1 кг) газа находится делением молярной теплоемкости на массу одного моля:
(теплоемкость 1 кг) газа находится делением молярной теплоемкости на массу одного моля:
 .
.
Проверим размерность:
 .
.
Для одноатомного газа
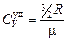 . (11.6)
. (11.6)
Вычислим удельную теплоемкость некоторых одноатомных газов.
Не: μНе = 0,004 кг/моль;  Дж/(кг×К);
Дж/(кг×К);
Nе: μNе = 0,020 кг/моль; 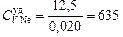 Дж/(кг×К);
Дж/(кг×К);
Ar: μAr = 0,040 кг/моль;  Дж/(кг×К);
Дж/(кг×К);
Kr: μKr = 0,084 кг/моль; 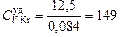 Дж/(кг×К).
Дж/(кг×К).
Замечание. Полученные значения теоретические, их еще надо проверить экспериментально.
Двухатомный газ. Если считать внутреннюю энергию n молей двухатомного газа равной 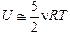 , то проводя аналогичные рассуждения, получим:
, то проводя аналогичные рассуждения, получим: 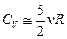 ;
;  ;
;  .
.
Итак, молярная теплоемкость для всех двухатомных газов при условиях, близких к нормальным, равна
 Дж/(моль×К) » 20,8 Дж/(моль×К).
Дж/(моль×К) » 20,8 Дж/(моль×К).
Вычислим удельные (теоретические) теплоемкости для некоторых двухатомных газов:
Н2:  = 0,002 кг/моль;
= 0,002 кг/моль; 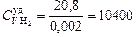 Дж/(кг×К);
Дж/(кг×К);
О2:  = 0,032 кг/моль;
= 0,032 кг/моль; 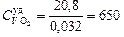 Дж/(кг×К);
Дж/(кг×К);
N2:  = 0,028 кг/моль;
= 0,028 кг/моль; 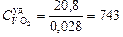 Дж/(кг×К).
Дж/(кг×К).
Задача 11.1. В закрытом сосуде находилось 20 г азота N2 и 32 г кислорода О2. Найти изменение внутренней энергии смеси этих газов при ее охлаждении на 28 К.
т1 = 0,020 кг
μ1 = 0,028 кг/моль
т2 = 0,032 кг
μ2 = 0,032 кг/моль
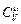 = 5/2 R,
DТ = –28 К = 5/2 R,
DТ = –28 К
| Решение.
DU = 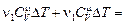 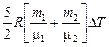 .
Подставим численные значения: .
Подставим численные значения:
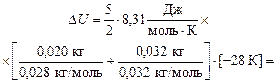
|
| DU = ? | |
= –997 Дж » –1,0 кДж.
Ответ: DU = 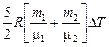 » –1,0 кДж.
» –1,0 кДж.
СТОП! Решите самостоятельно: А1, А2, В8.
Дата добавления: 2016-04-11; просмотров: 1252;
