Задачи средней трудности. В1. Вода с температурой 27 °С целиком заполняет закрытый сосуд объемом 1,0 л
В1. Вода с температурой 27 °С целиком заполняет закрытый сосуд объемом 1,0 л. Каким стало бы давление в этом сосуде, если бы
силы взаимодействия между молекулами воды исчезли?
В2. Каков объем одного моля идеального газа при давлении 1,0×105 Па и температуре 27 °С?
В3. До какой температуры нужно нагреть запаянный шар, содержащий 17,5 г воды, чтобы шар разорвался, если известно, что стенки шара выдерживают давление не более 100 атм, а объем его 1,0 л?
В4.Сжиженные газы хранят в сосудах, сообщающихся с атмосферой. В одном из таких сосудов объемом в 10 л находилось 0,50 л жидкого азота, плотность которого 0,81 г/см3. По ошибке сосуд был плотно закупорен. Разорвет ли сосуд, когда азот испарится и нагреется до комнатной температуры? Сосуд может выдерживать давление 20 атм.
В5.716 мгорганического соединения с формулой (С2Н6О)п дают при 200 °С и давлении 750 мм рт. ст. 242,6 см3 пара. Найти число п.
В6. Определить молекулярную формулу некоторого соединения углерода с водородом, если известно, что при температуре t = 27 °С и давлении р = 760 ммрт. ст. объем V= 1лэтого вещества в газообразном состоянии имеет массу т = 0,65 г. Атомный вес углерода M1 = 12, водорода M2 = 1.
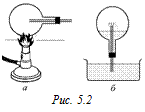 В7. В классе был показан такой опыт. Стеклянный баллон (рис. 5.2,а), в который вставлена открытая с обоих концов трубка, нагревался на спиртовке. Затем конец трубки был опушен в воду. Вода начала подниматься по трубке и бить фонтанчиком (рис. 5.2,б). До какой температуры был нагрет воздух, если в баллон вошла вода, заполнившая его объем на 20 %? Температура воздуха в классе 20 °С.
В7. В классе был показан такой опыт. Стеклянный баллон (рис. 5.2,а), в который вставлена открытая с обоих концов трубка, нагревался на спиртовке. Затем конец трубки был опушен в воду. Вода начала подниматься по трубке и бить фонтанчиком (рис. 5.2,б). До какой температуры был нагрет воздух, если в баллон вошла вода, заполнившая его объем на 20 %? Температура воздуха в классе 20 °С.
В8. Некоторый газ массы т1 = 7,0 г при температуре t1 = 27 °С создает в баллоне давление p1 = 50 кПа. Водород массы т2 = 4,0 г при температуре t2 = 60 °С создает в том же баллоне давление р2 = 444 кПа. Какова молярная масса m1 неизвестного газа? Молярная масса водорода m2 = =0,0020 кг/моль.
В9.10 г кислорода находятся под давлением 0,303 МПа при температуре 10 °С. После нагревания при постоянном давлении кислород занял объем 10 л. Найти начальный объем и конечную температуру газа.
В10. Определить разность масс воздуха, заполняющего помещение объемом 50 м3, зимой и летом, если летом температура помещения достигает 40 °С, а зимой падает до 0°С. Атмосферное давление считать нормальным.
В11. Из баллона со сжатым водородом вместимостью 10 л вследствие неисправности вентиля утекает газ. При 7,0 °С манометр показывает давление р = 5,0 МПа. Показание манометра не изменилось и при 17 °С. Определить массу вытекшего газа.
В12.В баллоне объема V = 0,20 м3 находится гелий при давлении р1 = =0,10 МПа и температуре t1 = 17 °С. Массу гелия в баллоне увеличили, при этом его давление повысилось до р2 = 0,30 МПа, а температура – до t2 = 47 °С. На сколько увеличилась масса гелия? Молярная масса гелия m = 0,0040 кг/моль.
В13. В баллоне находится газ при температуре 15 °С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 °С?
В14. В баллоне находится газ, давление которого 131,3×105 Па, а температура 30 °С. Из-за утечки газа его давление в баллоне понизилось до 2,02×105 Па, а температура до –25 °С. Какая часть газа осталась в баллоне?
В15. В сосуде находится озон при температуре 527 °С. По прошествии некоторого времени он полностью превратился в кислород, а его температура упала до 127 °С. На сколько процентов изменилось при этом давление?
В16. До какой температуры нужно нагреть колбу, содержащую воздух при 20 °С, чтобы его плотность уменьшилась в 1,5 раза?
Задачи трудные
С1. Нагревается или охлаждается идеальный газ при расширении, если его давление р и объем V связаны соотношением: p = const/Vп? Рассмотреть случаи: а) п > 1; б) п = 1; в) п < 1.
C2. Баллон, содержащий 1 кг азота, при испытании взорвался при температуре 350 °С. Какое количество водорода (в граммах) можно хранить в этом баллоне при 20 °С, имея пятикратный запас прочности? Считать прочность баллона не зависящей от температуры.
С3.Аэростат наполнен водородом при температуре t1 = 15 °С и давлении 1 атм. При неизменном давлении атмосферы под влиянием солнечной радиации его температура поднялась до t2 = 37 °С, а излишек газа М вышел через клапан, благодаря чему вес аэростата с газом уменьшился. Известно, что М = 6 кг. Определить объем аэростата V.
С4. Из баллона со сжатым кислородом израсходовали столько кислорода, что его давление упало со значения р1 = 9,8 МПа до р2 = 7,84 МПа. Какая часть массы кислорода израсходована?
С5. Некоторая масса молекулярного водорода занимает объем V1 = l м3при температуре Т1 = 250 К и давлении р1 = 2 атм.Какое давление р2 будет иметь та же масса водорода при температуре Т2 = 5000 К в объеме V2 = 10 м3,если при столь высокой температуре молекулы водорода полностью диссоциируют на атомы?
С6. Воздух в открытом сосуде нагревают от температуры t1 = 10 °C до температуры t2 = 600 °С. Затем, герметически закрыв сосуд, охлаждают воздух в нем до первоначальной температуры t1. Найти плотность воздуха в сосуде при температуре t2 и после охлаждения. Плотность воздуха при нормальных условиях r0 = 1,3 кг/м3. Тепловым расширением сосуда пренебречь.
С7. По газопроводной трубе идет углекислый газ при давлении р = 4 атми температуре t = 7° С. Какова средняя скорость движения газа в трубе, если за время t = 10 минпротекает т = 2 кгуглекислого газа и если площадь сечения канала трубы S = 5 см2?
Дата добавления: 2016-04-11; просмотров: 2701;
