Атомная единица массы. Число Авогадро
Вещество состоит из молекул. Под молекулой мы будем понимать наименьшую частицу данного вещества, сохраняющую химические свойства данного вещества.
Читатель: А в каких единицах измеряется масса молекул?
Автор: Массу молекулы можно измерять в любых единицах массы, например в тоннах, но поскольку массы молекул очень малы: ~10–23 г, то для удобства ввели специальную единицу – атомную единицу массы (а.е.м.).
Атомной единицей массы называется величина, равная 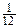 -й массы атома углерода 6С12.
-й массы атома углерода 6С12.
Запись 6С12 означает: атом углерода, имеющий массу 12 а.е.м. и заряд ядра – 6 элементарных зарядов. Аналогично, 92U235 – атом урана массой 235 а.е.м. и зарядом ядра 92 элементарных заряда, 8О16 – атом кислорода массой 16 а.е.м и зарядом ядра 8 элементарных зарядов и т.д.
Читатель: Почему в качестве атомной единицы массывзяли именно 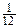 (а не
(а не 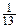 или
или 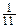 ) часть массы атома и именно углерода, а не кислорода или плутония?
) часть массы атома и именно углерода, а не кислорода или плутония?
Автор: Атом углерода 6С12 состоит из 6 протонов, 6 нейтронов и 6 электронов. Масса протона приблизительно равна массе нейтрона, а масса электрона примерно в 2000 раз меньше массы протона. Поэтому
1 а.е.м. = 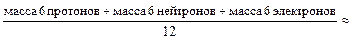
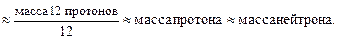
Экспериментально установлено, что 1 г » 6,02×1023 а.е.м.
Число, показывающее, во сколько раз масса 1 г больше 1 а.е.м, называется числом Авогадро: NA = 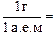 6,02×1023.
6,02×1023.
 Отсюда
Отсюда
NА × (1 а.е.м) = 1 г. (5.1)
Пренебрегая массой электронов и различием в массах протона и нейтрона, можно сказать, что число Авогадро приблизительно показывает, сколько надо взять протонов (или, что почти то же самое, атомов водорода), чтобы образовалась масса в 1 г (рис. 5.1).
Моль
Масса молекулы, выраженная в атомных единицах массы, называется относительной молекулярной массой.
Обозначается Мr (r – от relative – относительный), например:
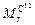 = 12 а.е.м,
= 12 а.е.м, 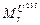 = 235 а.е.м.
= 235 а.е.м.
Порция вещества, которая содержит столько же граммов данного вещества, сколько атомных единиц массы содержит молекула данного вещества, называется молем(1 моль).
Например: 1) относительная молекулярная масса водорода Н2: 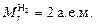 , следовательно, 1 моль водорода имеет массу 2 г;
, следовательно, 1 моль водорода имеет массу 2 г;
2) относительная молекулярная масса углекислого газа СО2:
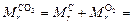 12 а.е.м. + 2×16 а.е.м. = 44 а.е.м.
12 а.е.м. + 2×16 а.е.м. = 44 а.е.м.
следовательно, 1 моль СО2 имеет массу 44 г.
Утверждение. Один моль любого вещества содержит одно и то же число молекул: NА = 6,02×1023 шт.
Доказательство. Пусть относительная молекулярная масса вещества Мr (а.е.м.) = Мr × (1 а.е.м.). Тогда согласно определению 1 моль данного вещества имеет массу Мr (г) = Мr×(1 г). Пусть N – число молекул в одном моле, тогда
N×(масса одной молекулы) = (масса одного моля),
отсюда
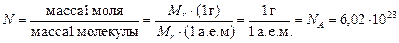 .
.
Моль – основная единица измерения в СИ.
Замечание. Моль можно определить иначе: 1 моль – это NА = = 6,02×1023 молекул данного вещества. Тогда легко понять, что масса 1 моля равна Мr (г). Действительно, одна молекула имеет массу Мr (а.е.м.), т.е.
(масса одной молекулы) = Мr × (1 а.е.м.),
(масса одного моля) = NА ×(масса одной молекулы) =
= NА × Мr × (1 а.е.м.) = 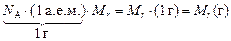 .
.
Масса 1 моля называется молярной массой данного вещества.
Читатель: Если взять массу т некоторого вещества, молярная масса которого равна m, то сколько это будет молей?
Автор: Подсчитаем:
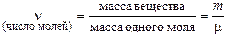 .
.
Запомним:
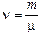 . (5.2)
. (5.2)
Читатель: А в каких единицах в системе СИ следует измерять m?
Автор: Посмотрим: [m] = 1 кг , [n] = 1 моль, тогда
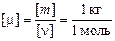 , [m] = кг/моль.
, [m] = кг/моль.
Например, молярная масса водорода
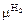 = 2 г/моль = 0,002 кг/моль;
= 2 г/моль = 0,002 кг/моль;
молярная масса углекислого газа
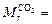 44 г/моль = 0,044 кг/моль
44 г/моль = 0,044 кг/моль
и т.д.
Закон Авогадро
Экспериментально установлено, что при нормальных условиях (Т0 = 273 К, р0 = 760 мм рт. ст.) 1 моль любого газа занимает одинаковый объем, равный 22,4 л (22,4×10–3 м3).
Напомним, что 760 мм рт. ст. = 1 атм » 1,013×105 Па.
Молярный объем
Физическая величина, равная отношению объема, занятого газом, к числу молей данного газа, называется молярным объемом газа:
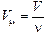 . (5.3)
. (5.3)
Единица измерения молярного объема
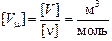 .
.
Объем газа можно выразить через молярный объем:
V = nVm. (5.4)
Дата добавления: 2016-04-11; просмотров: 5509;
