Аміачні методи очищення газів від двоокису сірки
В цих методах поглинання діоксиду сірки проводиться аміачною водою або водними розчинами сульфіт-бісульфіт амонію з послідуючим його видаленням. Перевагою методу є висока ефективність процесу, доступність сорбенту та отримання необхідних продуктів (сульфіт і бісульфіт амонію). Хімічні реакції процесу:
NH4OH + H2SO3 = (NH4)2SO3 +2H2O, (5.39)
(NH4)2SO3+ H2SO3 = 2NH4HSO3, (5.40)
2(NH4)2SO3 + O2 = 2(NH4)2SO4 (5.41)
Маються циклічні і нециклічні методи. В аміачно-нециклічному методі бісульфіт амонію випускають як товарний продукт. У циклічному методі одержують концентрований диоксид сірки. Схема установки очистки газу від диоксиду сірки аміачно-циклічним методом представлена на рисунку 5.36.
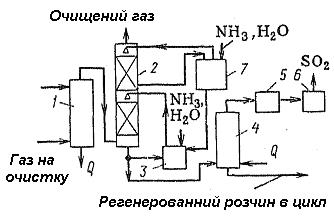
Рисунок 5.36 – Схема установки очистки газу від диоксиду сірки аміачно-циклічним методом
1 – колона; 2 – абсорбер; 3 – ємність; 4 – відпарна колона; 5 – конденсатор; 6 – осушувач; 7 - ємність
Попередньо очищений газ охолоджують водою в колоні, а потім подають на двоступінчасту абсорбцію. Друга ступінь необхідна для більш тонкого очищення. На I ступеню циркулюючий розчин має концентрацію NH3 8—10 моль на 100 моль води, а на II ступеню – 1-2 моль на 100 моль. При абсорбції виходить розчин, у якому відношення концентрації SO2 у сульфіті і бісульфіті до концентрації аміаку 0,78-0,82.
Абсорбент регенерують в отпарній колоні паром при 90 °С, залишковий тиск складає 500-550 мм рт. ст. У результаті розкладання бісульфату амонію і (частково) інших солей, що виділяється з розчину, діоксид сірки осушують і його використовують як товарний продукт (після конденсації пари води й абсорбції аміаку) або переробляють у сірку чи сірчану кислоту. Регенерований у відгінній колоні розчин прохолоджують і повертають у цикл зрошення.
Для виділення з розчину сульфату амонію частину регенерованого розчину випарюють, а потім кристалізують і збезводнюють на центрифузі (ця стадія на малюнку не показана). Готовий продукт має склад (у %): (NH4)2SO4 – 90-93, (NH4)2SO3 - 2-3; NH4HSO3 - 0,5-1 і Н2О – 4-5.
При підвищених температурах йде реакція:
NH4HSO3 + (NH4)2SO2 → (NH4)2SO4 + S + H2O (5.42)
У Франції розроблений аміачно-бісульфітний процес (рисунок 5.37), що дозволяє очищувати гази будь-якого складу. У даному процесі сульфат амонію розкладають при 300 0С, аміак, який виділяється, і бісульфіт амонію повертаються у процес:
(NH4)2SO4 → NH3 + NH4HSO4 (5.43)

Рисунок 5.37 - Схема установки очистки газів від двоокису сірки аміачно-бісульфітним методом
1 - абсорбер, 2 - ємкість, 3 - відпарна колона, 4 - вузол випаровування, 5 - сушарка
Недолік методу – велика енергоємність. Запропоновано процес, по якому у відходящий газ, що містить SO2, додають газоподібний аміак. Безпосередньо в трубі утворюється аерозоль сульфіту і сульфату, який уловлюють у електрофільтрах.
Розроблений аміачно-азотнокислотний метод очищення газів, що відходять, від діоксида сірки сульфіт-бісульфітним розчином з подальшим розкладанням отриманих розчинів азотною кислотою:
(NH4)SO3 + 2HNO3 → 2NH4NО3 + SO2 + H2O, (5.44)
NH4HSO3 + HNO3 = NH4NО3 + SO2 + H2O (5.45)
У результаті виходить газ, що містить 15-30 %, SO2, який переробляють у сірчану кислоту і нітрат амонію, який використовують як добриво. На 1 т диоксида сірки, що утилізують, можна одержати 1,3 т сірчаної кислоти, 3 т рідких азотних добрив і близько 0,2 т сульфату амонію з домішкою нітрату амонію.
Можливий аміачно-фосфорнокислий спосіб очищення, при якому утворюються фосфорні добрива і диоксид сірки:
3(NH4)2SO3 + 2H3PO4 → 2(NH4)3PO4 + 3SO2 + Н2О, (5.46)
3NH4HSO3 + H3PO4 → (NH4)3PO4 + 3SO2 + 3H2O (5.47)
5.18 Очистка газів від сірководню (карбонатний, фосфатний, процесс Тайлокс)
Сірководень міститься як домішка в природному газі і нафтових, коксохімічних газах, виділяється при випарюванні целюлозних щолоків. Для очищення газів від сірководню застосовують різні хемосорбційні методи.
Вакуум-карбонатні методи. У цих методах сірководень поглинають з газів водним розчином карбонату натрію або калію. Потім розчин регенерують нагріванням під вакуумом, охолоджують і знову повертають на абсорбцію. В основі методів лежать реакції:
Me2CO3 + H2S = MeHCO3 + MeHS, (5.48)
MeHS + CO2 + H2O = MeHCO3 + H2S (5.49)
Технологічна схема очищення газу від сірководню вакуум-карботантним методом з отриманням з сірководню сірчаної кислоти наведена на рисунку 5.38. Концентрація соди в поглинаючому розчині складає 15-18 %, температура абсорбції – 40 0С, ступінь абсорбції – 90 %. Після очищення газу в абсорбері розчин подають у холодильник - конденсатор, де його підігрівають за рахунок тепла конденсації парів, що виділяються при регенерації поглинального розчину. Потім розчин проходить теплообмінник і підігрівач і надходить у регенератор. Розчин регенерують кип'ятінням під вакуумом (15,6 кПа). Регенерований розчин направляють в ємність, а потім через теплообмінник і холодильник на зрошення абсорбера. Пари сірко-водню та води, які виділяються при регенерації розчину, відсмоктують вакуум-насосом через конденсатор-холодильник, де конденсується значна частина парів води. Далі пари надходять в холодильник, а потім у піч для спалювання сірководню. З печі газова суміш, що складається з діоксиду сірки, водяної пари, кисню і інертних газів, при 900 0С надходить в котел-утилізатор, де охолоджується до 400-450 0С, а потім прямує на окислення в контактний апарат. Після окислення гази направляють на абсорбцію для отримання сірчаної кислоти.
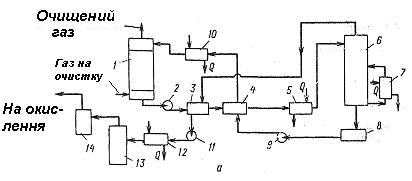
Рисунок 5.38 - Схема установки очищення газів від сірководню вакуум-карбонатним методом: 1 - абсорбер, 2, 9 - насоси, 3 - холодильник-конденсатор, 4 - теплообмінник, 5 - підігрівач, 6 - регенератор, 7 - циркуляційний підігрівач , 8 - збірник, 10 - холодильник, 11 - вакуум-насос, 12 - холодильник, 13 - піч, 14 - котел-утилізатор
Фосфатний процес. Для абсорбції сірководню фосфатним методом застосовують розчини, що містять 40-50 % фосфату калію:
K3PO4 + H2S → KHS + K2HPO4 (5.50)
Температура абсорбції 20-40 0С, степінь абсорбції - 92-97 %. З розчину сірководень видаляють кип'ятінням при 107-115 0С. Перевагою процесу є також селективність розчину до сірководню в присутності SO2.
Процес Тайлокс( «Tiloks»). В цьому процессі абсорбентом є миш'яково-содовий розчин, який отримують розчиненням As2O3 в розчині Na2CO3. При цьому відбувається реакція:
2Na2CO3 + As2O3 + H2O → 2Na2HAs2O3 + 2CO2 (5.51)
Одержання поглинаючого розчину відбувається в процесі взаємодії з сірководнем:
2Na2HAs2O3 + 5H2S → Na4As2S5 + 6H2O, (5.52)
Na4As2S5 + O2 → Na4As2S5O2 (5.53)
Отриманий розчин оксісульфомишьяково-натрієвої солі і є поглинювальним розчином для сірководню. Абсорбція протікає по реакції:
Na4As2S5O2 + H2S → Na4As2S6O + H2O (5.54)
При регенерації отриманої солі киснем повітря виділяється сірка:
2Na4As2S6O + O2 → 2Na4As2S5O2 + 2S (5.55)
Сірку відокремлюють від розчину, а регенерований розчин повертають на абсорбцію.
Опис технологічної схеми (рисунок 5.39). Очищуваний газ надходить в абсорбер, де відбувається його очищення від сірководню. Далі насичений сірководнем розчин перекачують через теплообмінник, де він нагрівається до 40 0С і потім надходить на регенерацію. У регенератор подають стиснене повітря, яке барботує через розчин. Після окислення киснем повітря та відділення сірки, котра спливає разом з бульбашками повітря в сепараторі, розчин повертають на абсорбцію. Сірку відокремлюють на вакуум-фільтрі. На інтенсивність абсорбції впливає концентрація миш'яку в поглиначі і рН розчину. При збільшенні концентрації з 15 до 25 г/дм3 ступінь абсорбції сірководню зростає з 81 до 97 %. Оптимальне значення рН має бути 7,8-7,9. Недоліком процесу є велика витрата соди (400-500 кг на 1 т сірки), великий вміст домішок в абсорбенті, що ускладнює його регенерацію.
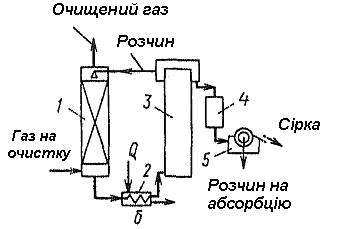
Рисунок 5.39 - Схема установки очищення газів від сірководню у процесі Тайлокс: 1 - колона, 2 - теплообмінник, 3 - колона для окислення, 4 - ємність, 5 - фільтр
Дата добавления: 2016-03-27; просмотров: 2183;
