Абсорбційні методи очистки забруднених газів. Теоретичні основи абсорбції, рівновага у системі газ-рідина, кінетичні закономірності процесу
До фізико-хімічних методів очищення газових викидів належать абсорбція і адсорбція. Абсорбція - це процес хімічного осадження або зв'язування забруднювальних речовин під час пропуску очищуваного газу крізь рідкий поглинач. Апарати для такого очищення називають абсорберами. У цих апаратах газ, який очищують і рідина для абсорбції рухаються назустріч один одному.
У хімічній промисловості абсорбцію застосовують для отримання готового продукту шляхом поглинання газу рідиною, поділу газових сумішей для виділення одного або кількох цінних компонентів, очищення газів від домішок шкідливих компонентів, уловлювання цінних компонентів з газової суміші. Абсорбцію застосовують для очищення повітря і відхідних газів, які містять токсичні забруднення - кислотні тумани, оксиди карбону (IV) і (II), ціанідну або ацетатну кислоти, сірчистий газ, оксиди нітрогену, різні розчинники тощо.
Абсорбент повинен задовольняти наступним вимогам: мати досить високу поглинальну здатність стосовно компонента, який витягується з газу; легко регенеруватися при десорбції; мати високу селективність стосовно компонента, який видаляють; невисоку летючість; не чинити корозійного впливу на апаратуру; мати можливо низьку вартість і доступність для промислового використання. Як абсорбенти, що відповідають зазначеним вимогам, використовують воду та водні розчини лугів (поглинання кислих газів), а також малолетучі органічні розчинники (диметиланілін - SО2, моно-етаноламін - сірководень, етанол амін - СО2).
Як поглинач використовують суспензії, які містять оксиди магнію і кальцію або вапняк:
СаО + N02 ® СаNОз, (5.22)
СаО + СО2 ® СаСО3, (5.23)
МgО + SО2 ® МgSО3, (5.24)
СаО + SО2 ® СаSО3, (5.25)
СаСОз + 2НС1 ® СаС12 + Н2О + СО2 (5.26)
Ефективність очищення складає 90-95 %. Шлами після очищення можуть використовуватися для подальшої переробки та отримання продуктів. Недоліком цих апаратів є ускладнення процесу видалення шламів у разі утворення важкорозчинних речовин.
Регенерацію поглиначів проводять фізичними методами: підвищенням температури, зниженням тиску, або сполученням зазначених параметрів. Якщо компонент, який витягують, не представляє цінності або процес регенерації пов'язаний з великими труднощами, то поглинач використовують одноразово.
Теоретичні основи абсорбції
Рівновага в системі газ - рідина. Під час абсорбції відбувається взаємодія між газом і розчином, в якому втримується речовина, яка взаємодіє з цим газом. Іноді розчинюючий газ взаємодіє безпосередньо з розчинником. Дослідні дані з розчинності газів у рідинах наведені в довідниках. Коли концентрація розчиненого газу мала, а температура і тиск далекі від критичних значень, рівновага в системах газ - рідина визначається законом Генрі:
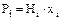 або
або 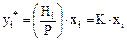 (5.27)
(5.27)
де 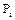 - парціальний тиск і-го компонента в газах під час рівноваги;
- парціальний тиск і-го компонента в газах під час рівноваги;
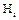 - константа Генрі і-го компонента, наявна розмірність тиску;
- константа Генрі і-го компонента, наявна розмірність тиску;
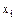 - молярна частка і-го компонента в рідині;
- молярна частка і-го компонента в рідині;
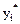 - молярна частка і-го компонента в газовій фазі під час рівноваги;
- молярна частка і-го компонента в газовій фазі під час рівноваги;
Р - загальний тиск;
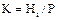 - безрозмірна константа.
- безрозмірна константа.
Константа Генрі збільшується зі зростанням температури, при чому зберігається співвідношення:
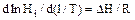 (5.28)
(5.28)
де 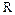 - універсальна газова постійна;
- універсальна газова постійна;
Т — температура;
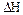 - теплота абсорбції.
- теплота абсорбції.
Коли газ вступає в розчині у хімічну реакцію, закон Генрі слід застосувати не до загальної концентрації розчиненого газу, а до концентрації непрореагованого газу.
Кінетичні закономірності. Залежно від особливостей взаємодії поглинача і компонента, який добувають із газової суміші, абсорбційні методи поділяються на методи, що базуються на закономірностях фізичної абсорбції, і методи абсорбції, які супроводжуються хімічною реакцією в рідкій фазі.
У процесах фізичної абсорбції перенесення в межах фази визначається рівняннями масовіддачі:
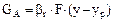 , (5.29)
, (5.29)
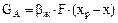 (5.30)
(5.30)
Перенесення речовини з одної фази в іншу описується рівнянням масопередачі:
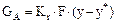 , (5.31)
, (5.31)
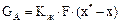 (5.32)
(5.32)
Зв'язок коефіцієнта масопередачі з коефіцієнтом масовіддачі:
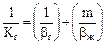 , (5.33)
, (5.33)
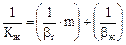 (5.34)
(5.34)
де 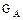 - кількість речовини, яка переноситься за одиницю часу при фізичній абсорбції, кмоль/год.;
- кількість речовини, яка переноситься за одиницю часу при фізичній абсорбції, кмоль/год.;
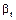 і
і 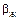 - коефіцієнти масовіддачі відповідно в газовій і рідкій фазах, м/г;
- коефіцієнти масовіддачі відповідно в газовій і рідкій фазах, м/г;
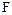 - поверхня контакту фаз, м2;
- поверхня контакту фаз, м2;
у і х — концентрації компонента, який передається в газовій і рідкій фазах, кмоль/м3;
ур, хр - концентрації компонента, який передається на межі поділу фаз в газі і рідині, кмоль/м3;
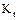 ,
, 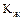 - коефіцієнти масопередачі, віднесені до концентрації в газовій і рідинній фазах, м/год.;
- коефіцієнти масопередачі, віднесені до концентрації в газовій і рідинній фазах, м/год.;
у* - концентрація компонента в газі, рівноваги з концентрацією газу, кмоль/м3;
х - концентрація компонента в рідині, врівноважена з концентрацією газу, кмоль/м3;
т - константа фазової рівноваги (ур = m·х0).
У системах з високою розчинністю m наближається до 0, тому 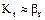 . Отже, у такій системі газ - рідина весь опір масопередачі сконцентрований на боці газу. При малій розчинності газу в рідині m має велике значення, тому
. Отже, у такій системі газ - рідина весь опір масопередачі сконцентрований на боці газу. При малій розчинності газу в рідині m має велике значення, тому 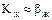 . В такому разі весь опір масопередачі сконцентрований в рідкій фазі. Оскільки величина
. В такому разі весь опір масопередачі сконцентрований в рідкій фазі. Оскільки величина 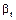 значно більша, ніж
значно більша, ніж 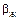 то процес абсорбції відбуватиметься швидше в системі з дифузійним опором масопередачі в газовій фазі, розміри апарата в цьому випадку будуть менші.
то процес абсорбції відбуватиметься швидше в системі з дифузійним опором масопередачі в газовій фазі, розміри апарата в цьому випадку будуть менші.
Під час хімічної реакції в рідкій фазі компонент, який адсорбує, вступає в реакцію з поглиначем. Зростає градієнт концентрації біля поверхні поділу, порівняно з фізичною абсорбцією швидкість поглинання збільшується. При цьому чим більша швидкість хімічної реакції, тим більше прискорення абсорбції. Воно може бути враховане збільшенням коефіцієнта масовіддачі в рідкій фазі, якщо рухому силу вважати такою самою, як і при фізичній абсорбції, або збільшенням рухомої сили при рівновазі коефіцієнтів масовіддачі в рідкій фазі для фізичної абсорбції і хемосорбції.
Рівняння масовіддачі при хемосорбції має такий вигляд:
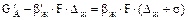 (5.35)
(5.35)
Коефіцієнт прискорення абсорбції в рідкій фазі під час хімічної реакції:
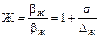 (5.36)
(5.36)
Зв'язок коефіцієнта масопередачі з коефіцієнтом масовіддачі при хемосорбції визначається рівняннями:
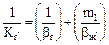 , (5.37)
, (5.37)
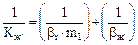 (5.38)
(5.38)
де 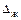 - рухома сила абсорбції;
- рухома сила абсорбції;
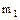 - константа газової рівноваги для фізичної абсорбції з поправкою на іонну силу розчину;
- константа газової рівноваги для фізичної абсорбції з поправкою на іонну силу розчину;
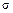 - величина, на яку підвищується рухома сила в рідкій фазі під час хімічної реакції.
- величина, на яку підвищується рухома сила в рідкій фазі під час хімічної реакції.
Тут значення із штрихом відповідають параметрам абсорбції, яке супроводжує хімічну реакцію.
Коефіцієнт прискорення залежить від швидкості хімічної реакції і ступеня турбулізації рідини. Незворотна хімічна реакція в рідкій фазі приводить до нульового значення рівнозваженого парціального тиску газу в широкому діапазоні концентрації. У випадку швидкої незворотної реакції між розчинним газом і хімічним реагентом, розчиненим и рідкому стані, або самого рідкого стану як реагентом 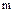 має невелике значення.
має невелике значення.
Відносний опір газового і рідкого стану в процесі дифузії при абсорбції, яка супроводжується хімічною реакцією, є функцією не тільки коефіцієнта дифузії розчинного газу в газовому і рідкому стані, розчинності газу і часу проникнення, але і концентрації реагенту, який не прореагував у рідкому стані, і швидкості реакції.
Дата добавления: 2016-03-27; просмотров: 2187;
