Смешивающиеся жидкости
В зависимости от соответствия жидкостей входящих в смеси закону Рауля жидкости подразделяются на следующие подгруппы:
жидкости, которые образуют идеальные растворы (подчиняющиеся закону Рауля);
жидкости, образующие смеси, частично отклоняющиеся от закона Рауля, но не образующие смесей с постоянной температурой кипения;
жидкости, образующие смеси со значительным отклонением от закона Рауля, т.е. смеси с постоянной максимальной или минимальной температурой кипения (азеотропные смеси), а именно: в первом случае - азеотропная смесь кипит при температуре выше, чем исходные жидкости, во втором случае -ниже.
Закон Рауля « Парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе»
Рап = Раб ( 1 – х ) , ( 5.1)
где Рап – давление паров абсорбента в растворе;
Раб – давление паров чистого абсорбента в условиях абсорбции;
х - мольная доля абсорбируемого газа в растворе.
Вопрос о взаимной растворимости (смешиваемости) жидкостей уже издавна привлекает к себе внимание ввиду большого теоретического и практического интереса, который он представляет.
В отношении взаимной растворимости жидкостей часто применяемым является давно уже установленное эмпирическое правило «подобное растворяет подобное». Жидкости, близкие между собой по составу, строению и величине молекул, оказываются всегда хорошо растворимыми друг в друге. Так, углеводы хорошо растворяются в углеводах, спирты в спиртах.
Рассмотрим наиболее простой случай парожидкого равновесия двухкомпонентной смеси, которая образует идеальный раствор, подчиняющийся закону Рауля.
Исходным являются два компонента (растворитель и растворимое вещество) близкие по составу и строению молекул.
Введем обозначения:
А – растворитель;
В - растворимое вещество;
РА – давление насыщенных паров растворителя;
РА- давление насыщенных паров раствора в свободном состоянии;
ΝА - мольная доля растворителя;
ΝВ - мольная доля растворимого вещества.
В таких простейших смешивающихся жидкостях давление насыщенного пара РА данного компонента А над раствором прямо пропорционально относительному содержанию его молекул в растворе т.е. его мольной доле:
ΡА = К · ΝА ; (5.2.)
При ΝА = 1 давление насыщенного пара РА представляет собой давление насыщенного пара данного компонента в свободном состоянии 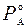 . Следовательно, К=
. Следовательно, К= 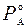 и равенство принимает вид:
и равенство принимает вид:
РА = ΝА · 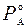 ; ( 5.3 )
; ( 5.3 )
Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NВ связано с NА простым соотношением
NА + NВ = 1.
Определяя отсюда NА и подставляя в (1.2), получим:
РА = (1 - NВ) · 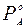 ; (5.4)
; (5.4)
Графическая форма этого соотношения приведена на рисунке 5.1.
Из графического соотношения следует, что:
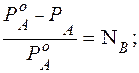 (5.5)
(5.5)
Разность ( РА0 – РА) называется понижением давления насыщенного пара, а отношение ( РА0 – РА)/ РА0 – относительным понижением давления насыщенного пара.
Рисунок 5.1.Графическая форма классификации смешивающихся
жидкостей.
По закону Дальтона общее давление насыщенных паров в системе равно сумме парциальных давлений насыщенных паров компонентов
Р = РА + РВ ( 5.6 )
Дата добавления: 2016-02-16; просмотров: 1323;
