Для частиц различной формы
| Форма частицы | Относительные размеры частицы | аv | ||
| проектированный диаметр | толщина | длина | ||
| Шар | 1,0 | 1,0 | 1,0 | 0,455 |
| Куб | 1,3 | 1,0 | 1,7 | 0,303 |
| Пластина | 1,9 | 1,0 | 2,0 | 0,231 |
| Осколок | 2,0 | 1,0 | 3,0 | 0,183 |
| Чешуйка | 3,0 | 0,8 | 4,0 | 0,104 |
| 8,0 | 0,8 | 10,0 | 0,040 | |
| Игла | 1,5 | 1,0 | 3,0 | 0,212 |
| 4,0 | 1,0 | 8,0 | 0,079 | |
| Волокно | 2,5 | 1,0 | 5,0 | 0,127 |
| 2,5 | 1,0 | 50,0 | 0,013 |
Распределение частиц может быть представлено различным образом. Наиболее наглядным является графический способ, при котором результаты оформляются в виде гистограмм, полигонов распределения, ложных дифференциальных, интегральных и дифференциальных кривых. По кривой можно также охарактеризовать и распределение частиц в полидисперсной системе. В качестве примера на рис. 2.2 приведена дисперсность распыленных частиц сгущенного молока.
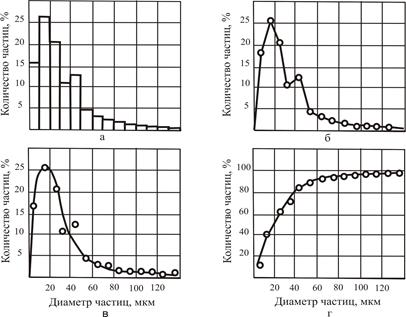
Рис. 2.2. Характеристики дисперсности распыленных частиц сгущенного молока: а) гистограмма распределения частиц; б) полигон распределения частиц; в) ложная дифференциальная кривая распределения частиц; г) интегральная кривая счетного распределения частиц (по Н.Н. Липатову и В.Д. Харитонову)
Особенностью высокодисперсных систем, как ранее было отмечено, является наличие высокоразвитой границы раздела фаз. Влияние поверхностей раздела фаз и связанных с ними поверхностных явлений на свойства дисперсных систем обусловлено существованием избыточной поверхностной энергии. Одно из наиболее важных следствий существования поверхностной энергии - капиллярные явления, связанные с воздействием искривленных поверхностей на контактирующие фазы.
Удельную поверхность, отнесенную к единице объема или массы, для дисперсных систем, содержащих частицы, можно определить из выражений:
S/уд=  , (2.15)
, (2.15)
S//уд= 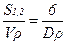 , (2.16)
, (2.16)
где S/уд - площадь удельной поверхности, отнесенная к единице объема;
S//уд - площадь удельной поверхности, отнесенная к единице массы;
S1,2 - площадь межфазной поверхности;
V - суммарный объем дисперсной фазы;
r - плотность дисперсной фазы.
Как следует из этих выражений, с увеличением количества частиц, например, при их измельчении, удельная поверхность дисперсной системы увеличивается. Если частицы несферические, то для нахождения удельной поверхности необходимо ввести в расчет коэффициент формы, который лежит в диапазоне значений от 1 до 10.
Для оценки несферичности поверхности частиц используют показатель «кривизна поверхности», под которым понимают коэффициент, определяемый как производная.
Н= 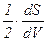 (2.17)
(2.17)
Для сферической поверхности радиуса r
Н= 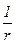 ,(2.18)
,(2.18)
для нити цилиндрической формы
Н= 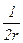 ,(2.19)
,(2.19)
для частиц неправильной формы
Н= 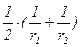 ,(2.20)
,(2.20)
где r1 и r2 - радиусы окружностей, полученных при прохождении через поверхность и нормаль к ней в данной точке двух перпендикулярных плоскостей.
Две фазы могут существовать в однокомпонентной системе в равновесии только при наличии устойчивой границы раздела между ними, не проявляющей тенденции к самопроизвольному увеличению (термодинамически устойчивой при постоянных температуре и объеме системы). С макроскопической точки зрения это означает, что с поверхностью связана некоторая энергия, так что общая свободная энергия системы не является суммой энергии двух объемных фаз, а включает еще избыточную свободную энергию, пропорциональную площади S поверхности раздела фаз - свободную поверхностную энергию Fs.
Fs= 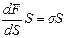 (2.21)
(2.21)
где s - удельная (приходящаяся на единицу площади поверхности) свободная поверхностная энергия (поверхностное натяжение), Дж/м2 или Н/м.
Поверхностное натяжение можно трактовать и как силу, действующую вдоль поверхности раздела (тангенциально к ней) и препятствующее ее увеличению. Наличие на поверхности раздела фаз избытка энергии означает, что для образования новой поверхности требуется совершить работу, поэтому величина s одновременно представляет собой работу обратимого изотермического образования единицы поверхности.
Используя приведенные формулы можно оценить многие индивидуальные свойства и установить закономерности формирования гетерогенных (многофазных) пищевых продуктов. Присущая черта является основной качественной характеристикой всего многообразия дисперсных систем пищевых продуктов.
Порошки и гранулы
Особенностью технологии порошковых и гранулированных продуктов является необходимость удаления влаги, которая образуется с наиболее тонкодисперсной частью системы паровую суспензию и выступает при формировании продукции в качестве пластификатора и временной технологической связывающей субстанции. Крупнодисперсная часть системы образует капиллярно-пористое тело, которое для нерастворимых и ненабухающих материалов при сушке практически не деформируется.
Наиболее распространенным способом удаления влаги из материалов является ее испарение при подводе тепла, т.е. сушка. Движущей силой процесса сушки является разность парциальных давлений водяного пара на поверхности высушиваемого материала и в окружающей среде. Интенсивность сушки обусловлена различными факторами, которые в конечном итоге определяют качество конечного продукта, в частности, изменения, которые с ним происходят (усадка с образованием трещин и т.д.). К наиболее значимым факторам, определяющим закономерности сушки, относятся содержание влаги и ее формы в продукте, температура, состав и свойства исходных систем.
Основой материального баланса сушильных установок является условие, что количество сухих веществ при отсутствии потерь одинаково в исходном и готовом продукте:
G1S1=G2S2, (2.22)
где G1 - масса исходного продукта, кг;
S1 - массовая доля сухих веществ в исходном продукте, %;
G2 - масса готового продукта, кг;
S2 - массовая доля сухих веществ в готовом продукте, %;
Биологические растительные материалы, подвергаемые сушке наиболее часто, состоят из морфологических и функционально однородных клеток, которые соединяются в ткань с помощью срединных пластинок (состоит из гемицеллюлоз и пектиновых веществ), тяжей протоплазмы - плазмодесм и непрерывной водной фазы.
Всякий влажный материал состоит из твердой, жидкой и газообразной фаз. Твердая фаза имеет твердый скелет в виде кристаллической решетки или каркаса хаотического строения. Жидкая фаза характеризуется подвижностью частиц, несжимаемостью, почти неизменной плотностью, мало зависящей от давления и температуры. Газообразная фаза отличается сжимаемостью, высоким значением объемного расширения. В сушильных процессах влажный материал рассматривается как смесь абсолютно сухого вещества и влаги:
М=Мс+W, (2.23)
где М - масса влажного материала, кг;
Мс - масса абсолютно сухого материала, кг;
W - масса влаги, кг.
Влажность материала w0 определяется отношением массы влаги к общей массе влажного материала:
w0=  =
= 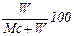 . (2.24)
. (2.24)
Влажность материала w0 изменяется от 0 при W=0 (абсолютно сухой материал) до 100 % при Мс=0 (чистая вода).
Обозначим массу материала влажностью w10 до сушки через М1, массу материала влажностью w20 после сушки через М2. Тогда количество испаренной влаги составит:
W= М1-М2, (2.25)
В процессе сушки масса абсолютно сухого материала не изменяется.
Мс=M  . (2.26)
. (2.26)
Обозначим массу абсолютно сухого вещества до сушки Мс1=М1(100- w10)/100, после сушки Мс2=М2(100-w20)/100. Из равенства Мс1=Мс2 следует, что:
М1(100- w10)/100= М2(100- w20)/100. (2.27)
Из уравнения (2.27) получим уравнение массы испаренной влаги в процессе сушки:
W= 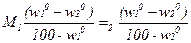 . (2.28)
. (2.28)
Влажность материала w0 характеризует материал в стационарных условиях, но в процессе сушки этой величиной нельзя пользоваться, т.к. масса влажного материала в ходе процесса сушки непрерывно уменьшается. Неизменной при сушке остается лишь масса абсолютно сухого вещества Мс.
В технике пользуются понятием влагосодержания материала, выраженного в процентах или в килограммах на килограмм.
wс=  или u=
или u= 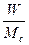 (2.29)
(2.29)
Влагосодержание материала wс изменяется от 0 при W=0 (абсолютно сухой материал) до бесконечности при Мс=0 (чистая вода).
Масса абсолютно сухого материала с учетом его влагосодержания:
Мс=M  . (2.30)
. (2.30)
Аналогично выведенному ранее уравнению (2.29) количеству испаренной влаги в процессе сушки:
W= 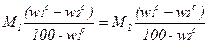 . (2.31)
. (2.31)
Пересчет влагосодержания wс на влажность w0 и наоборот, производится по уравнениям:
wс=  . (2.32)
. (2.32)
w0= 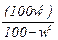 . (2.33)
. (2.33)
Растительные материалы как объекты сушки отличаются от химических, строительных, топливных и других материалов неживой природы клеточным строением и свойствами влаги. Практически все изменения, происходящие с сырьем при сушке, связаны со свойствами диполей воды. Содержащуюся в продуктах воду можно разделить на свободную и связанную. Свободная вода характеризуется теми же свойствами, что и чистая вода. Почти вся вода, содержащаяся в пищевых продуктах, находится в связанном состоянии, но удерживается тканями с различной силой. В основу классификации связанной воды, предложенной П.А. Ребиндером, положена природа образования различных форм связи и энергии связи, под которой понимают ту энергию, которую необходимо затратить на разрушение этой связи при удалении влаги из материала. Формы связи влаги с материалом в порядке убывающей энергии подразделяются на три группы: химическую, физико-химическую и физико-механическую.
Химически связанная вода связана в виде гидроксильных ионов или заключена в кристаллогидраты. Такая связь является самой прочной и может быть удалена из продукта только путем химического взаимодействия или при прокаливании.
Физико-химически связанная вода делится на адсорбционно-связанную и осмотически поглощенную. Адсорбционно-связанная вода удерживается силовым полем на внешней и внутренней поверхности мицелл коллоидного тела, которые характеризуются весьма значительной дисперсностью частиц, условный радиус которых составляет 0,01-0,1 мкм. Вследствие такой дисперсности коллоидные тела обладают огромной межфазной поверхностью, за счет которой происходит адсорбционное связывание воды. При адсорбционном связывании первого мономолекулярного слоя воды с коллоидным телом происходит выделение теплоты адсорбции. Кроме того, происходит сжатие объема, при котором объем набухшего тела становится меньше суммы объемов материала и поглощенной воды. Физико-механически связанная вода удерживается в неопределенных соотношениях и обычно свободно выделяется из продуктов высушиванием или даже прессованием. Физико-механически связанную воду делят на связанную макрокапиллярами (размер капилляра более 10-5 м) и микрокапиллярами (размер капилляра менее 10-5 м). Продукты в большинстве имеют макро- и микрокапиллярное строение. Капиллярную влагу можно рассматривать как свободную, она перемещается в капиллярах продукта в виде жидкости и пара. Различные виды связи воды в пищевых продуктах обусловливают механизм удаления этой воды при их сушке.
Осмотически поглощенная вода связывается макроколлоидами пищевых продуктов с высокополимерным строением. При образовании геля часть воды захватывается внутрь скелета геля и находится там в полупроницаемом контуре. Другая часть осмотически поглощенной воды проникает внутрь геля через стенки клеток из окружающей среды в результате осмоса. Осмотически связанная влага поглощается без выделения тепла и без сжатия системы.
На сегодняшний день пищевые продукты систематизированы по показателю активности воды и делятся на три группы: продукты высокой влажности (массовая доля влаги более 40 %, показатель активности воды колеблется от 0,9 до 1,0); продукты со средней или промежуточной влажностью (массовая доля влаги от 10 до 40 %, показатель активности воды варьируется от 0,6 до 0,9); продукты низкой влажности, массовая доля воды менее 20 % (показатель активности воды варьируется от 0 до 0,6).
Показатель активности воды является величиной непостоянной и изменяется под действием осмотически активных добавок, например, гелеобразователей. Большое влияние оказывает температура окружающей среды. Исследования Loneir и Weisser по замораживанию воды и определению ее активности показывают, что при 0°С активность воды равна 1, а при минус 20°С активность воды уменьшается до 0,78. При этом уменьшается доступность воды для биохимических и химических превращений, тем самым продлевается срок хранения пищевых продуктов.
Показатель активности воды дает многостороннюю оценку и характеристику пищевого продукта. Этот показатель используют при оценке консистенции продукта, изменении вязкости при сгущении и гелеобразовании, оценке возможности протекания химических реакций в водной фазе продукта, оценке возможного роста микроорганизмов, полезной и вредной микрофлоры, протекания биохимических реакций.
Порошки представляют собой одну из распространенных форм дисперсий. Физико-химические свойства порошков определяются силой контактного взаимодействия частиц, поэтому для решения как прикладных, так и фундаментальных теоретических задач в области физико-химической механики целесообразным представляется установление связи между макрореологическими характеристиками слоя порошка и силой взаимодействия частиц.
Обязательной технологической операцией изготовления порошков является измельчение высушенного материала. Измельчение заключается в его деформировании до момента разрушения или разрыва (дробление бобов какао, помол пшеницы в муку и др.).
Известно, что механические характеристики описывают поведение твердого материала под действием прилагаемой нагрузки. К механическим характеристикам относят предел упругости, предел прочности на разрыв, предельное напряжение сдвига и область пластичности. Схематично механические характеристики материалов показаны на рис. 2.3.
|
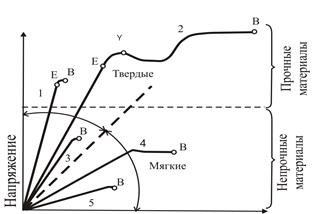
Рис. 2.3. Механические характеристики материалов: 1 - твердый, прочный и хрупкий; 2 - твердый, прочный, пластичный; 3 - твердый, непрочный, хрупкий; 4 - мягкий, непрочный, пластичный; 5 - мягкий, непрочный, хрупкий; Е - предел упругости; Y - предел текучести; B - предел прочности; EY - неупругая деформация; YB - область пластичности (по М. Лонцину и Р. Мерсону)
Прочность материала зависит от наличия трещин или других дефектов в его структуре. В образцах значительных размеров даже небольшая нагрузка может вызвать разрыв материала при очень незначительной деформации из-за большого количества дефектов структуры. С уменьшением размера образца материала количество дефектов уменьшается, и предел прочности возрастает. Для разрыва небольших частиц необходимо преодолеть межмолекулярные силы. Вследствие этого очень трудно осуществлять измельчение частиц, размеры которых меньше определенной величины.
Твердость является свойством материала, которое необходимо учитывать при расчетах процессов измельчения. Для определения твердости часто применяют эмпирическую шкалу Моса: тальк - 1, гипс - 2, кальцит - 3, фторошпат - 4, апатит - 5, полевой шпат - 6, кварц - 7, топаз - 8, корунд - 9, алмаз - 10. Твердость можно также измерить по сопротивлению материала продавливанию при локальном сжатии, как, например, в испытаниях на твердость.
Гранулирование дисперсных систем представляет собой процесс превращения сухой сыпучей или влажной бесформенно агрегированной системы в одинаковые по размеру, плотности и прочности шарообразные гранулы. Широкое распространение процесса объясняется преимуществом гранулированного продукта по сравнению с сыпучим материалом. Гранулы транспортабельны, не запыляют атмосферу, хорошо дозируются, не подвергаются слеживанию и выветриванию. Применение гранулированных материалов обеспечивает переход от периодических процессов к непрерывным. Более того, полислойное гранулирование позволяет воздействовать на процессы переработки многокомпонентных сырьевых смесей.
Гранулирование методом окатывания в настоящее время производится по трем направлениям, обусловленным различным составом и свойствами гранулируемого материала. Первое направление (для окатывания тонкодисперсных продуктов фильтрования после глубокого обогащения) предусматривает поступление сырья в гранулятор с близким содержанием жидкой фазы. Корректировка количества жидкой фазы до оптимума производится путем доувлажнения или присадкой к ней небольших количеств сухих влагоемких добавок. Достоинство данного направления состоит в большой скорости образования и роста гранул. Однако стабильность процесса невелика из-за частых колебаний влажности системы.
По второму направлению сырье поступает в гранулятор в сухом виде. Жидкую фазу в гранулятор подают отдельно. Трехфазная комкуемая система образуется непосредственно в процессе гранулирования. Достоинство этого способа заключается в четкости и оперативности регулирования процесса гранулирования. Однако вследствие ограниченного поступления влаги смачиваемость ограничена. Это не только в целом замедляет интенсивность гранулообразования, но и также является причиной пылеобразования.
Третье направление получило наибольшее распространение и представляет собой «полумокрое» окатывание, суть которого состоит в том, что исходное сырье имеет влажность около 70-80 %, а остальные 20-30 % подается непосредственно в гранулятор в процессе гранулирования. При этом скорость процесса не зависит от смачивания гранул.
В зависимости от способа гранулирования при окатывании дисперсного материала различают стадию образования зародыша, рост гранул и уплотнение гранул. Стадия уплотнения налагается как на стадию образования устойчивого зародыша, так и на стадию его роста, и самостоятельно проявляется лишь на заключительном этапе гранулирования. Более плотные, следовательно, более прочные агрегаты способствуют ускорению и стабилизации процессов образования зародышей и росту гранул. Кинетика уплотнения дисперсного материала определяет и механизм гранулирования в целом.
Эффективность процесса гранулирования определяется факторами, влияющими на качество готовой продукции. Скорость роста гранул зависит от объемного влагосодержания, гранулометрического состава исходной системы, конструкционных особенностей аппарата. В зависимости от способа окатывания на скорость и стабильность процесса гранулообразования существенное влияние оказывают также стадии зародышеобразования и роста гранул.
Рост и уплотнение гранул находятся в прямой зависимости от скорости капиллярного теплообмена. Поверхность растущей гранулы должна быть переувлажнена, чтобы обеспечить налипание частиц сырьевой смеси. Такая избыточная влага переносится при уплотнении из ядра, с одной стороны, за счет возникающего капиллярного потенциала, а с другой - за счет чисто механического выдавливания. На этой стадии процесс гранулообразования лимитируется скоростью капиллярного массообмена при уплотнении.
Гранулирование проводят при температурах, близких к температуре сушки, что способствует уменьшению количества жидкости, необходимой для коагуляции. Протекающие реакции гидратации сокращают количество жидкости до требуемой величины, которая препятствует потере прочности гранул при сушке.
В целом технологический процесс получения порошков и гранул целесообразно рассматривать как самостоятельный химико-технологический процесс, течение которого предопределяется физико-химическими процессами и явлениями. В качестве общих факторов, определяющих технологические закономерности формирования рассматриваемых дисперсий, являются: форма и размер частиц, их распределение по размерам, расположение частиц в пространстве, объемное содержание частиц в системе, агрегатное состояние, стабильность и изменчивость отдельных параметров системы. Варьирование именно этих характеристик позволяет получить материалы с заданными составом и свойствами, а также оптимизировать технологические процессы по оптимальной траектории достижения цели.
Гели
Большинство пищевых продуктов являются твердыми телами, механические и физико-химические свойства которых обусловлены гелеобразным состоянием. Гели (или студни) представляют собой многокомпонентные системы, содержащие макромолекулярные вещества и низкомолекулярную жидкость (воду) и обладающие свойствами твердых тел. Пищевые гели обычно содержат 50-90 % и более воды, а в качестве гелеобразователя - белки, полисахариды, их смеси и комплексы. Свойства гелей обусловлены образованием пространственной сетки взаимодействующими макромолекулами.
Золи и суспензии, а также их производные - гели и пасты - являются разновидностями одного и того же типа дисперсных систем - твердое в жидком. Значительная часть продуктов представляет собой гели и пасты, а на различных стадиях технологического процесса, кроме них, полуфабрикатами являются золи и суспензии. Золи относятся к высокодисперсным системам, суспензии являются средне- и грубодисперсными системами (одно из отличий от золей). Золи являются седиментационно-устойчивыми системами. Жидкая дисперсионная среда золей позволяет молекулярно-кинетическим явлениям проявиться наиболее интенсивно. Суспензии, наоборот, характеризуются седиментационной неустойчивостью, т.е. не способны сохранять неизменным во времени распределение частиц дисперсной фазы в объеме системы (не способны противостоять силе тяжести).
При увеличении концентрации частиц дисперсной фазы системы из свободнодисперсных превращаются в связнодисперсные, т.е. переходят в пасты. Для приготовления паст применяют вещества, имеющие повышенную вязкость и температуру кипения. Наиболее распространены вещества с макромолекулярной структурой, в которых равномерно распределены гидрофильные группы, с которыми вступает во взаимодействие вода. Независимо от вида взаимодействия вода оказывается связанной, молекулы воды теряют свою подвижность в коллоидной системе, изменяя при этом консистенцию продукта.
Гели - структурированные высокодисперсные системы с жидкой дисперсионной средой, состоящие из заполненного жидкостью каркаса, который образует структуру из твердых частиц дисперсной фазы. Гели относят к двухфазным системам с высокоразвитой поверхностью раздела между фазами: непрерывной или мелкодисперсной фазой твердого материала, взвешенного в водной (или с каким-либо растворителем) фазе, которая также может быть непрерывной или частично дисперсной. Твердое вещество обычно рассматривают как волокнистое построение. Оно может состоять или из труднорастворимых молекул, например, белковых веществ, или из нитеобразных кристаллов, таких, как гели кремниевой кислоты или кристаллической целлюлозы. Степень структурной устойчивости таких систем зависит от строения каркаса непрерывной фазы таким образом, что система, как целое, обладает многими свойствами твердого тела независимо от агрегатного состояния дисперсионной среды и дисперсной фазы в отдельности.
Количество воды или другого растворителя, содержащегося в геле, зависит от многих факторов. Если гель распределен в избыточном количестве растворителя, он обычно набухает до тех пор, пока не образуется золь. Ограниченное набухание приводит к образованию студней. Они во многом схожи с гелями: и те и другие являются структурированными системами, содержат связанную и свободную воду или другую жидкость, обладают признаками твердого тела и жидкости и проявляют специфические свойства, к числу которых относится синерезис. Студни получаются из растворов высокомолекулярных веществ (ВМС), а гели - из золей, т.е. коллоидных растворов. В зарубежной и отечественной литературе не делают различий между гелем, полученным из золя, и студнем, сформированным из макромолекул ВМС.
На гелеобразование может влиять ряд факторов. Концентрация дисперсной фазы сильно сказывается на скорости образования геля и его прочности, т.к. с повышением численной концентрации число контактов, приходящихся на единицу объема системы, и скорость установления контактов возрастает. Уменьшение размера частиц при постоянной концентрации дисперсной фазы также способствует гелеобразованию. Очень большое значение имеет форма частиц.
На скорость образования и свойства полученного геля весьма сильно влияет температура. Продолжительность образования геля при повышении температуры уменьшается. Механическое воздействие обычно препятствует образованию геля.
В настоящее время растворение высокомолекулярных веществ принято рассматривать, как процесс смешения двух жидкостей, который обусловлен как энергетическим взаимодействием между молекулами растворяемого вещества и растворителя, так и действием энтропийного фактора, характеризующего равномерное распределение молекул растворенного вещества в растворе. При набухании в воде растворение протекает в две стадии. Макромолекулы в аморфных высокомолекулярных веществах упакованы сравнительно неплотно и при тепловом движении между гибкими цепями образуют щели, в которые диффундируют молекулы воды. Происходит гидратация макромолекул, сопровождающаяся выделением теплоты, разрушением связей между отдельными макромолекулами, упорядоченным расположением молекул воды около макромолекул, поэтому на первой стадии растворения энтропия системы даже понижается. На второй стадии, когда связи между отдельными макромолекулами сильно ослаблены, они отрываются от основной массы вещества и диффундируют в среду, образуя однородный истинный раствор. На этой стадии процесс растворения обусловлен чисто энтропийными причинами.
Чем больше молекулярная масса вещества, тем медленнее происходит процесс набухания и растворения. При прочих равных условиях набухание не всегда заканчивается растворением. Одна из причин такого явления может заключаться в том, что высокомолекулярное вещество и растворитель способны смешиваться ограниченно. Другая причина состоит в том, что между молекулами высокомолекулярного вещества могут существовать поперечные химические или межмолекулярные связи. Такое вещество, по существу, представляет пространственную сетку, которая препятствует отрыву макромолекул друг от друга и переходу их в раствор. Ограниченное набухание с повышением температуры уменьшается, а скорость набухания возрастает, т.к. повышение температуры способствует ускорению установления равновесного состояния системы.
Процессы, проходящие в большей части систем «золь - гель», могут быть обратимыми при изменении температуры. Температура плавления обратимого геля обычно выше температуры его затвердевания. Это отстаивание называется гистерезисом. Однако температуры плавления и затвердевания могут быть одинаковыми, если будет поддерживаться незначительная скорость изменения температуры. Многие гели могут перейти в жидкое состояние при механическом перемешивании, но после некоторого периода покоя они снова приобретают свое первоначальное полужидкое состояние. Такое поведение является следствием изменения электрического потенциала сил притяжения и отталкивания между коллоидными частицами. Условия равновесия этих сил имеют место лишь при определенных расстояниях между частицами. Когда частицы перемешиваются, равновесие нарушается и наблюдается разжижение. Гели, обнаруживающие такие свойства, называются тиксотропными (способность структуры после разрушения ее связей под влиянием механических воздействий со временем самопроизвольно их восстанавливать в результате броуновского движения). Такое разрушение и восстановление связей структуры может происходить не только в случае покоящейся системы, но и при ее течении.
Гелям присуще явление синерезиса (старение). Синерезис - процесс постепенного сжатия сетки (матрицы). Причина синерезиса заключается в том, что при гелеобразовании между элементами структуры образуется сравнительно малое число контактов, не отвечающее предельно уплотненному состоянию структуры. Затем в результате перегруппировки частиц, обусловленных их тепловым движением, число этих контактов увеличивается, что неизбежно приводит к сжатию геля и выпрессовыванию из него дисперсионной среды. Синерезису лагоприятствуют увеличение концентрации электролита, повышение температуры, введение в систему десольватирующих агентов. Синерезису способствует также гибкость и подвижность элементов коагуляционной структуры, поэтому особенно значительный синерезис наблюдается у студней высокомолекулярных веществ, состоящих из гибких макромолекул.
Фибриллярные (волокнообразные) компоненты геля связаны силами, которые могут быть ковалентными по природе, но обычно более слабыми, например, водородные связи. Эти связи нарушаются или разрываются силами, приложенными к гелю. В случае разрушения они могут быть восстановлены в другом месте, на соседних молекулах. Связи эти весьма чувствительны к изменениям температуры и с ее повышением заметно теряют свою устойчивость.
Гели состоят из поперечно связанных полимерных молекул, которые образуют матрикс, погруженный в дисперсионную среду (влагу). Для пищевых гелей характерны связи дисульфидные, как правило, возникающие в белковых гелях в виде сегментов из двух или более полимерных молекул. Эти связи являются слабыми, способными к разрыву и легкому восстановлению. Основными, наиболее часто встречающимися типами связей, являются водородные, электростатические, ван-дер-ваальсовые и гидрофобные.
Полимерные цепи ассоциируются за счет образования межмолекулярных двойных спиралей с образованием упорядоченных доменов, но сами каркас геля не образуют. Непосредственное образование геля происходит с последующим агрегированием этих доменов в промежуточном положении путем конкретного связывания желирующих катионов. По другой версии гелеобразование происходит в результате взаимодействия конкретных катионов, образующих устойчивые связи между полимерными цепями гелеобразователя при охлаждении.
Известно, что образование геля в белковых системах происходит под действием сил Ван-дер-Ваальса и посредством водородных связей. Белковые гели непрочные, исключение составляют казеиновые гели, образованные в присутствии ионов кальция. Для получения гелей в систему вводят различные вещества: каррагинаны, пектины, карбоксиметилцеллюлозу, модифицированные крахмалы и другие структурообразователи. Указанные пищевые добавки придают продуктам специфический вкус и используют при производстве гелеобразных продуктов в кондитерской, мясной и других отраслях пищевой промышленности. Сахароза положительно влияет на прочность геля в результате образования в системе кальциевых и сульфгидрильных мостиков. В процессе желирования участвуют гидроксильные группы сахарозы, глицеридов, многоатомных спиртов. Пектиновые гели образуются только в присутствии сахарозы, которая играет роль дегидратирующего компонента.
Для получения пищевых продуктов с заданной консистенцией широко применяют желирующие вещества (агар, пектины, модифицированные крахмалы, желатин), изменяющие реологические свойства продукта. Ассортимент веществ, улучшающих консистенцию достаточно широк - это загустители, гелеобразователи и студнеобразователи, пищевые поверхностно-активные вещества, а также стабилизаторы физического состояния и разрыхлители. Химическая природа этих веществ разнообразна. Для получения требуемой консистенции используют как вещества неорганической природы, так и вещества растительного и микробного происхождения.
Правомочно предположить, что пищевые полисахариды построены в основном из шестичленных циклических D-сахаров, что связано с тем, что моносахариды в L-форме составляют всего 25 % от общего числа сахаров.
В научной литературе имеются сведения о разных классификациях структурообразователей. Существует несколько классификационных признаков структурообразователей, трактующих разные подходы. Наиболее распространенные факторы классификации:
- по источникам выделения различают структурообразователи животного, растительного и микробиологического происхождения;
- по происхождению - натуральные, биосинтетические, синтетические, полусинтетические, которые, в свою очередь, делятся на экссудаты, водорослевые сухие экстракты и порошки, получаемые из семян растений.
В химическом отношении эти пищевые добавки очень схожи. Это макромолекулы, в которых равномерно распределены гидрофильные группы, с которыми вступает во взаимодействие вода. У гелеобразователей возможно обменное взаимодействие с неорганическими ионами, в особенности с ионами водорода и кальция, с меньшими органическими молекулами, например, олигосахаридами и т.д. В этих случаях вода оказывается связанной, что приводит к потере ею подвижности в коллоидной системе и изменению консистенции пищевого продукта. Загустители образуют с водой высоковязкие растворы, а студнеобразователи и желирующие агенты - гели. При этом одни и те же вещества в зависимости от их концентрации в пищевом продукте могут выполнять как роль загустителя, так и гелеобразователя и/или студнеобразователя.
Макромолекулы полисахаридов построены из моносахаридов химических связей ковалентной природы, которые жестко фиксируют С-первый атом мономерной единицы через кислородный мостик со вторым, третьим, четвертым или шестым атомом углерода последующей мономерной единицы. Такая связь называется гликозидной (a- или b-) в зависимости от аномерной конфигурации. Многообразие возможных вариантов соединения моносахаридов приводит к образованию периодических (например, в молекуле целлюлозы D-глюкозные остатки соединены b-(1®4) связями, прерываемых (например, a-L-рамноза, «вклиниваясь» в последовательность a-(1®4) связанных D-остатков галактуроновой кислоты и их метильных эфиров, прерывает периодичность полигалактуроновой кислоты, которая является основным компонентом пектинов) или апериодических структур (иррегулярная последовательность сахаридов). Из этого следует, что с геометрической точки зрения структура цепи полисахаридов может быть линейной, линейной с боковыми заместителями и разветвленной.
При производстве пищевых продуктов используют натуральные и полусинтетические добавки. К натуральным загустителям и студнеобразователям относят растительные камеди и слизи, выделяемые из семян льна и айвы, рожкового дерева, астрагала, аравийской акации; агар, агароид, пектин, желатин, альгинат натрия. К полусинтетическим относятся производные натуральных веществ, физико-химические свойства которых изменены в требуемом направлении введением функциональных групп: карбоксиметилцеллюлоза, метилцеллюлоза, амилопектин, этилцеллюлоза, модифицированные крахмалы.
В процессе взаимодействия полисахаридов с водой участвует большое количество химических групп. Кроме атомов кислорода, ОН-, СН-, СН2-групп, взаимодействуют карбонильные, N-ацетильные, сульфатные, метильные, метоксильные и другие группы. Однако рассмотрение одного только действия индивидуальных групп недостаточно. Определяющим фактором гидратационных свойств является относительная пространственная конфигурация гидроксильных групп.
В соответствии с природой контактных зон, которые удерживают вместе полимерные цепи в трехмерной пространственной структуре геля, идентифицировано три типа механизмов гелеобразования для случая обратимого образования полисахаридных гелей.
1. Класс полисахаридов, которые образуют гели при охлаждении горячих растворов с бифилярными (двойными) спиралями. Несколько нерегулярные структуры делают невозможным существование протяженных областей двойных спиралей, и, следовательно, любая одиночная полимерная цепь взаимодействует с более чем с одним партнером. Результатом является образование трехмерной пространственной структуры. В некоторых случаях сами двойные спирали проявляют заметную тенденцию агрегироваться в так называемые «сверхструктуры». К полисахаридам с таким механизмом гелеобразования относят агары.
2. Класс полисахаридов, которые при гелеобразовании образуют слоистую структуру. Так, например, альгинаты и низкомолекулярные (низкозамещенные) метоксипектины образуют гели при добавлении в раствор ионов кальция. Предполагается, что контактные зоны включают связанные двухвалентные катионы кальция.
3. Данный механизм можно классифицировать как механизм образования мицеллярных структур (гидроксипропилцеллюлоза, метилцеллюлоза). В этом случае гели образуются при нагревании холодных растворов, и считается, что механизм их образования включает гидрофобное взаимодействие тех участков цепей целлюлозы, где заместители расположены наиболее часто, а относительно незамещенные (и гидрофильные) части цепей остаются при этом в растворе свободными.
Роль воды в различных полисахаридных гелях окончательно не изучена. Для первого класса приведенной классификации полисахаридов следует отметить, что поскольку конформации спиралей почти не связаны с каким-либо водным окружением, что процесс образования бифилярных связей протекает в неводных растворителях. Однако, насколько известно, эти полисахариды не образуют гелей в неводных средах. Более того, предполагается, что вещества, разрушающие структуру воды, препятствуют образованию гелей, поэтому можно представить, что вода все-таки принимает некоторое участие в образование гелей. Возможно, ее роль состоит в том, что она определяет конформационные свойства данного полимера. Однако следует отметить, что природа гелей является, в первую очередь, результатом взаимодействия типа «полимер-полимер», а не следствием обширной упорядоченности воды.
Роль воды в гелях, образующихся путем мицеллообразования, изучена в большей степени. Механизм этого процесса характерен для водных растворов. Однако пространственная структура геля обусловлена образованием поперечных связей между полимерными цепями (сетчатая структура), а свойства растворителя, вероятно, проявляются лишь в незначительной степени. Следовательно, можно заключить, что роль воды при образовании геля состоит, главным образом, в осуществлении каталитической функции.
Гелеобразователи выполняют следующие функции: осуществляют коллоидную гидрофильную защиту белка, позволяя производить тепловую обработку; стабилизируют частицы, предохраняя их от осаждения; улучшают консистенцию готового продукта; связывают свободную воду, повышая вязкость смеси.
Гелеобразователи должны быть химически инертны по отношению к компонентам пищевых продуктов, т.е. не окислять липиды, не разрушать витамины. При этом они должны образовывать при определенных рН, концентрации и температуре водные растворы, обладающие структурной вязкостью, а при необходимости - формовать трехмерную сетку. Их системы, как правило, должны характеризоваться бесцветностью, а также быть лишены вкуса и запаха. Гелеобразователи должны являться естественными компонентами традиционных пищевых продуктов, вырабатываться в промышленном масштабе и быть дешевыми.
В качестве гелеобразователей применяют отечественные (желатин, агар, агароид, альгинат натрия, казеины, пектины, модифицированные крахмалы, метилцеллюлозу, фурцелларан) и зарубежные («Хамульсион», «Хан», «Crown») стабилизационные системы. Большинство стабилизаторов (гидроколлоидов) получены из животного (казеин, желатин) и растительного (пектин, метилцеллюлоза, агар) сырья. В настоящее время разработана большая группа гидроколлоидов путем химической обработки природных веществ (казеина, крахмала, пектина, целлюлозы).
Стабилизаторы можно разделить на следующие группы: белковые (желатин, казеины, соевые изоляты и концентраты и др.); растительные (гуммиарабик, гуммигати и др.); пектины (свекловичный, яблочный, цитрусовый, зоостерин и др.); целлюлозы (МЦ-100, натрийкарбоксиметилцеллюлоза и др.); камеди (микробные, растительные); экстракты водорослей (агар, альгинаты).
Используемые в технологии гелеобразователи должны быть безопасны, обладать необходимыми технологическими свойствами, обеспечивая экономичное расходование основного молочного сырья. Выбор конкретной стабилизационной системы должен учитывать функциональные свойства гидроколлоида, состав среды, режим производства и конкретный вид оборудования.
Агар (Е406) является классическим представителем класса загустителей, стабилизаторов и гелеобразующих веществ. Его получают из морских водорослей Белого моря и Тихого океана. Название этого полимера имеет малазийское происхождение и означает «желирующий продукт питания из водорослей». Основу агара составляет дисахарид агароза, молекула которой, построена из b-D-галактозы и 3,6-ангидро-L-галактозы. В скобках указан шифр по международной классификации пищевых добавок.
Свойства агара различаются в зависимости от его происхождения. Обычно агар состоит из смеси агароз, отличающихся по степени полимеризации; в их состав могут входить разные металлы (калий, натрий, кальций, магний) и присоединяться по месту функциональных групп. В зависимости от соотношения полимеров и вида металлов значительно изменяются свойства агара. Агар незначительно растворяется в холодной воде и набухает в ней, в горячей - воде образует коллоидный раствор, при остывании превращающийся в прочный студень, обладающий стекловидным изломом.
С гигиенической точки зрения агар безвреден и во всех странах допускается его использование в пищевых целях. Концентрация его не лимитирована и обусловлена рецептурами и стандартами на пищевые продукты. Агар применяют в кондитерской промышленности при производстве желейного мармелада, пастилы, зефира, при получении мясных и рыбных студней, желе, пудингов и т.д. При этом комитет экспертов ФАО/ВОЗ считает допустимой суточную дозу агара для человека 0-50 мг/кг массы тела, что значительно выше той дозы, которая может поступить в организм с продуктами.
Агароид (черноморский агар) получают из водорослей филлофлоры, растущих в Черном море. Основу агароида также составляет агароза. В молекулу агароида входят сульфокислые группы - 22-40 % от общего числа функциональных групп и карбоксильные - 3-5 %, тогда как в молекуле агара их соответственно 2-5 и 20-25 % от доли всех функциональных групп. Эти различия в структуре определяют и разную студнеобразующую способность, которая у агароида в 2-3 раза ниже чем у агара. Агароид, кроме того, имеет более низкие температуры плавления и застудневания, меньшую химическую устойчивость. В пищевой промышленности агароид находит аналогичное агару применение.
Фурцелларан (датский агар) - полисахарид, получаемый из морской водоросли фурцеларии. По способности к студнеобразованию он занимает промежуточное положение между агаром и агароидом и применяется при производстве мармелада и желейных конфет, ароматизированных молочных напитков и пудингов. Экспертным комитетом по пищевым добавкам ФАО/ВОЗ определена допустимая доза фурцелларана - до 75 мг на 1 кг массы тела.
Альгиновые кислоты и их соли (Е400, Е401, Е402, Е403, Е404) характеризуются студнеобразующими свойствами. Их получают из бурых водорослей. Они представляют собой полисахариды, состоящие из остатков D-маннуроновой и L-гулуроновой кислот. Альгиновые кислоты в воде не растворимы, но связывают ее. При нейтрализации карбоксильных групп альгиновой кислоты образуются альгинаты, которые растворимы в горячей и холодной воде.
Альгинатные гели устойчивы к действию как низких, так и высоких температур, что выгодно отличает их от гелей агар-агара, желатина, каррагинана. Они совместимы с белками и полисахаридами, несовместимы с водорастворимыми спиртами, кетонами, арабик-клейковиной. При добавлении молочной кислоты в гели альгиновой кислоты увеличивается стойкость по отношению к хелатам.
Реологические свойства альгинатного геля можно изменить в желаемом направлении путем «сшивания» структуры полисахарида, например, с помощью ферментов. Альгиновые кислоты и альгинаты используют в пищевой промышленности при производстве мармелада, фруктового желе, конфет в качестве студнеобразователя, а также при производстве других структурированных продуктов.
Согласно данным экспертного комитета по пищевым добавкам ФАО/ВОЗ альгиновая кислота, альгинат натрия, альгинат кальция и пропиленгликольальгинаты имеют статус пищевой добавки и суточные допустимые дозы для первых трех биополимеров составляют до 50 мг/кг, для пропиленгликольальгината - до 25 мг/кг.
Пектиновые вещества (Е440) - улучшители консистенции: загустители, уплотнители, студнеобразователи, стабилизаторы и эмульгаторы. Широкий спектр их действия обусловливает значительное применение их в пищевой промышленности.
Пектиновые вещества представляют собой высокомолекулярные полисахариды, входящие в состав клеточных стенок и межклеточных образований совместно с целлюлозой, гемицеллюлозой и лигнином. В понятие «пектиновые вещества» входят гидратопектин (растворимый пектин), протопектин (нерастворимый в воде пектин), пектиновые кислоты и пектинаты, пектовые кислоты и пектаты. Основным структурным признаком пектиновых веществ являются линейные молекулы полигалактуроновой кислоты, в которой мономерные звенья связаны a-1,4- гликозидной связью. В пищевой промышленности пектин получают из яблочных и цитрусовых выжимок, свекловичного жома, соцветий-корзинок подсолнечника, створок плодов-коробочек хлопчатника. В зависимости от вида сырья пектин имеет различные органолептические и физико-химические показатели.
Пектин, как и другие студнеобразователи, не растворяется в среде, где существуют условия для студнеобразования. Основными свойствами пектиновых веществ, которые определяют область их применения в пищевой промышленности, служат студнеобразующая и комплексообразующая способности. Студнеобразующая способность пектина зависит от ряда факторов: молекулярной массы, степени этерификации, количества балластных по отношению к пектину веществ, температуры и pH среды, содержания функциональных групп. Установлено, что в свекловичном пектине присутствуют феруловые группы, связанные сложноэфирной связью с боковыми цепями нейтральных сахаров. Использование персульфата аммония или перекиси водорода приводит к повышению истинной молекулярной массы растворимых пектинов и образованию прочного студня. Такие гели обладают высокой водоудерживающей способностью и находят применение в пищевой промышленности.
Комплексообразующая способность пектиновых веществ основана на взаимодействии молекулы пектина с ионами тяжелых и радиоактивных металлов (табл. 2.5). Это свойство дает основание рекомендовать пектин для включения в рацион питания лиц, находящихся в среде, загрязненной радионуклидами, или имеющих контакт с тяжелыми металлами.
Таблица 2.5
Связывание элементов (в % от добавленного компонента)
| Элемент | Пектин яблочного порошка | Низкометоксилированный яблочный пектин |
| Свинец | ||
| Медь | ||
| Цезий | ||
| Лантан | ||
| Цирконий | ||
| Никель |
Благодаря своей комплексообразующей способности пектин может быть отнесен к незаменимому веществу для использования в производстве пищевой продукции профилактического и лечебного питания. Оптимальная профилактическая доза пектина составляет не более 2-4 г в сутки для контактирующих с тяжелыми металлами, в условиях радиоактивного загрязнения – не менее 15-16. Отрицательного действия пектина не установлено и его применение в качестве пищевой добавки разрешено без ограничений во всех странах мира. Для амидированного пектина, у которого часть свободных карбоксильных групп превращена в амиды, установлена величина допустимого суточного потребления 25 мг/кг массы тела.
Каррагинаны (Е407) по химической природе близки к агару и агароиду. Их название происходит от названия ирландского г. Каррик. Каррагинаны называют также «ирландским мхом». Каррагинаны входят в состав красных водорослей, их структура гетерогенна. Различают несколько типов идеальных каррагинанов, обозначаемых греческими буквами «λ», «ξ», «χ», «ί», «μ» и «ν». Вид водоросли влияет на тип получаемого из него каррагинана. Их структурообразующие свойства, также как и растворимость в воде, зависят от фракционного состава каррагинанов. Например, очень гидрофильный λ-каррагинан, макромолекулы которого могут находиться друг от друга на значительном расстоянии, препятствующем образованию связей, является только загустителем. Макромолекулы χ- и ί-каррагинанов, растворяющиеся при повышенных температурах, и после охлаждения образуют зоны сцепления, характерные для структурной сетки геля, проявляя свойства студнеобразователей. Каррагинаны не расщепляются ферментами в желудочно-кишечном тракте и могут применяться в области производства низкокалорийных продуктов, а также для детоксикации.
Допустимая суточная доза по рекомендации Экспертного комитета по пищевым добавкам ФАО/ВОЗ - до 75 мг на 1 кг массы тела. Промышленное применение находит не только каррагинан, но и его натриевая, калиевая и аммонийная соль.
Желатин является также распространенным гелеобразователем. По своей структуре он представляет собой белок животного происхождения, в его составе присутствует смесь полипептидов с молекулярной 50000-70000, а также их агрегаты. Получают желатин из хрящей, сухожилий и костей сельскохозяйственных животных.
Желатин является продуктом тепловой, кислотной, щелочной или ферментативной денатурации коллагенов. Нефракционированный желатин содержит смесь a-, b-, g-цепей (два последних компонента представлены сшитыми химическими связями, сдвоенными или строенными a-цепями и их фрагментами). Разные по молекулярной массе фракции различаются своими коллоидно-химическими, физико-химическими, конформационно-конфигурационными параметрами и реакционной способностью.
Желатин - естественный компонент пищевых продуктов, поэтому ограничений по его применению нет. Однако следует учитывать, что продукты, содержащие желатин, могут иметь посторонний, не свойственный им привкус; кроме того, они в большей степени подвержены микробиологической порче. В промышленности желатин используют в различных композициях в количестве 1,5-2,2%.
Крахмал и модифицированные крахмалы (Е1402). Среди природных гелеобразователей в пищевой технологии самыми дешевыми и доступными являются крахмалы. Крахмал - полимер глюкозы с большинством связей по первому и четвертому углеродным атомам. При этом образуется высокомолекулярный линейный полимер амилоза, который не имеет боковых цепей, и разветвленный полимер амилопектин с боковыми цепями, образованными по десятому и шестому атомам углерода. Соотношение между амилозой и амилопектином у разных крахмалов колеблется от 1:1,5 до 1:4,5.
Сырьем для получения крахмала служат клубни картофеля, зерно кукурузы, пшеницы, риса и других растений. Содержание его зависит от вида сырья. От химического состава крахмала зависят его физико-химические свойства. Крахмальные зерна при обычной температуре не растворяются в воде, а при повышении температуры набухают, образуя вязкий коллоидный раствор, который при охлаждении превращается в устойчивый гель. Крахмал, его отдельные фракции (амилопектин и амилоза) и продукты частичного гидролиза находят применение в пищевой промышленности в качестве загустителей и гелеобразователей.
В последние годы в пищевой промышленности все больше применяют модифицированные крахмалы, свойства которых в результате разнообразных способов обработки (физического, химического, биологического) заметно отличаются от обычного крахмала по степени гидрофильности, способности к клейстеризации и студнеобразованию.
Следует отметить, что модифицированные крахмалы не идентичны по своему биологическому действию, особенно на растущий организм. В связи с этим комитет экспертов ФАО/ВОЗ по пищевым добавкам рекомендует по мере возможности исключать применение модифицированных крахмалов в качестве пищевой добавки в продуктах детского питания.
Наиболее распространенным в природе полисахаридом является целлюлоза (природные ресурсы 1×1011 метрических тонн ежегодно) В пищевой технологии находят применение только производные целлюлозы: микрокристаллическая целлюлоза (Е 460), метилцеллюлоза (Е461), карбоксиметилцеллюлоза (Е466), гидроксипропилцеллюлоза (Е463), гидроксипропилметилцеллюлоза (Е464), метилэтилцеллюлоза (Е465). Целлюлоза - основное вещество растительных клеток, которая составляет от 50 до 70 % всей массы. Чистая целлюлоза не растворяется в воде. Чтобы сделать целлюлозу растворимой, ее подвергают химической модификации путем введения реакционноспособных групп в гидроксильные группы молекулы полисахарида (метил-, карбоксиметил- и др.). Среди производных целлюлозы наибольшее значение имеют метилцеллюлоза и карбоксиметилцеллюлоза, которые получают, воздействуя алкилирующими реактивами, например галидными алкилами или диалкилсульфатами на алкилцеллюлозу.
Метилцеллюлоза имеет вид волокнистого порошка от белого до серо-белого цвета. При содержании менее двух метильных остатков на один остаток глюкозы она растворима в холодной воде, а в теплой - переходит в гель. Растворимость метилцеллюлозы уменьшается с повышением температуры. Она практически не растворяется в воде при температуре, близкой к температуре кипения.
Студнеобразование в растворах метилцеллюлозы вызвано, главным образом, гидрофобным взаимодействием неполярных группировок макромолекул. Карбоксиметилцеллюлоза имеет вид белого волокнистого порошка, растворимого в воде. Ее получают из чистой целлюлозы хлопка. Она адсорбирует воду в 50-кратном количестве, образуя коллоидные системы.
Объединенным комитетом ФАО/ВОЗ по пищевым добавкам установлены допустимые суточные дозы производных целлюлозы для человека в количестве от 0 до 30 мг/кг массы тела. В России производные целлюлозы не применяются, кроме натриевой соли карбоксиметилцеллюлозы, рекомендуемое содержание которой для гелеобразных продуктов составляет не более 5 г/кг.
Камеди синтезируются некоторыми видами деревьев, растущих в тропиках и субтропиках. В пищевой промышленности используют камеди гуммиарабика (Е414), трагаканта (Е413), карайя (Е416). Камеди получают путем снятия части коры с деревьев, что приводит к выделению вязкой смолы на поверхности древесины, которая стекает в приготовленные сосуды. После сбора продукт очищается и поставляется промышленности.
Камедь карайя - по химическому составу представляет ацетилированный полисахарид, содержащий L-рамнозу, D-галактозу и D-остатки галактуроновой кислоты. Она набухает в холодной воде в течение нескольких часов, образуя неоднородный густой гель. Добавление щелочи вызывает деацетилирование камеди и модификцию ее функциональных свойств. При введении в рацион в больших количествах камедь карайя у некоторых людей вызывает аллергические состояния. Установлено, что в организме человека не происходит метаболического распада карайи, и толерантный уровень содержания этого вещества (10 г в сутки) воспринимается без побочного воздействия.
Подробную информацию о свойствах и использовании гелеобразователей (как традиционных, так и новых) можно найти в специальной литературе. Поиском новых видов гелеобразователей посвящены исследования ведущих научных учреждений, а также коммерческих фирм.
Эмульсии
Другой дисперсной системой, используемой в пищевой промышленности, является эмульсия. Она представляет собой две взаимно нерастворимые жидкости. Для придания системе агрегативной устойчивости в систему вводят поверхностно-активные вещества (эмульгаторы). Процесс формирования дисперсной системы эмульсии представлен несколькими физико-химическими процессами, происходящими на границе раздела фаз. В эмульсии капельки дисперсной фазы защищены от слияния при столкновениях друг с другом межфазными пленками, которые играют роль дополнительного барьера, препятствующего их слиянию (коалесценции).
Эмульсии, как и другие дисперсные системы, являются термодинамически неустойчивыми, поскольку на границе раздела фаз существует некоторое количество свободной энергии, поэтому в них происходят процессы, приводящие к снижению свободной энергии системы, следовательно - самопроизвольное укрупнение частиц дисперсной фазы за счет их коалесценции (слияния). Устойчивость жировой фазы эмульсии, например, в молочных продуктах, следует признать достаточно высокой, поскольку для коалесценции жировых частиц необходимо применять интенсивное физико-механическое воздействие, а для флокуляции (слипания) необходимо время, а также низкие положительные температуры.
По концентрации дисперсной фазы эмульсии делят на разбавленные (объем дисперсной фазы не выше 0,1 %), концентрированные (объем дисперсной фазы до 74 %), высококонцентрированные или пенообразные (объем дисперсной фазы от 74 до 99 %).
Эмульсии получают конденсационным и диспергационным методом (при помощи смешения, гомогенизации и коллоидной мельницы). При получении эмульсии энергия необходима не только для образования новых поверхностей, но и для преодоления внутреннего трения. Специфической чертой эмульсий (рассматриваемых дисперсий) является возможность образования эмульсий двух типов: прямой, в которой дисперсионной средой является более полярная жидкость (обычно вода), и обратной, в которой более полярная жидкость образует дисперсную фазу. При определенных условиях наблюдается обращение фаз эмульсий, когда эмульсия данного типа в результате введения каких-либо реагентов или при изменении условий превращается в эмульсию противоположного вида. Определить тип эмульсий можно, например, по ее электрической проводимости (электрическая проводимость для водной дисперсионной среды на много десятичных порядков выше, чем у обратной эмульсии), по способности смешиваться с полярными и неполярными растворителями или растворять полярные и неполярные красители.
Диспергирование представляет собой процесс дробления частиц или капель (дисперсной фазы) и одновременно их равномерное распределение в дисперсионной среде. Дисперсионная среда - это всегда жидкость, а дисперсная фаза может быть жидкостью (при этом после гомогенизации получают эмульсию) или твердым материалом (после гомогенизации получают суспензию).
Для эмульгирования используют ультразвук большой мощности (на частотах менее 5 МГц). Для объяснения механизма эмульгирования ультразвуком используют представления о поверхностных волнах, которые имеют место в случае нестабильности Рэлея-Тейлора. При электрическом дроблении эмульсий исследователи обнаружили вытягивание и последующее дробление вытянутых нитей жидкости с последующим их распадом.
В настоящее время получение эмульсий в смесителях, коллоидных мельницах и гомогенизаторах распространено повсеместно. Другими перспективными способами получения эмульсий являются звуковые, ультразвуковые и электрофизические методы обработки. С помощью ультразвука удается получит эмульсии с размером частиц 1 мкм. Максимальная дисперсность системы наблюдается в диапазоне частот 960-1600 кГц для частиц, первоначальные размеры которых не превышают 1000 Å. С увеличением исходного размера частиц оптимум частиц понижается.
При воздействии ультразвука на гетерогенные системы наблюдается одновременное течение двух противоположных процессов - диспергирования и коагуляции. Окончательный результат зависит как от параметров ультразвукового поля, так и физико-химических характеристик самого продукта. Концентрация эмульсии, образующейся в результате одновременного течения процессов эмульгирования и коагуляции, в общем в виде описывается уравнением:
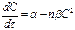 , (2.34)
, (2.34)
где с - концентрация эмульсии, %;
t - продолжительность процесса, с;
a, b - опытные величины, зависящие от свойств вещества;
n - величина, характеризующая вероятность протекания
реакции.
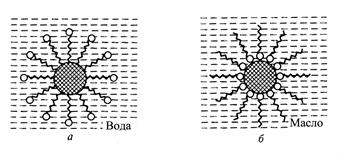
Для получения концентрированных эмульсий необходимо наличие третьего компонента - эмульгатора, образующего адсорбционные оболочки на поверхности диспергированных частиц (рис. 2.4).
|
Эмульгаторы делят на три основных класса в зависимости от механизма, вызывающего концентрирование их на поверхности раздела: вещества с интерполярной молекулярной структурой (полярные - соединения с длиной цепью типа жирных кислот и мыл); макромолекулярные коллоиды (соединения типа белков), молекулы которых сильно удлинены, однако они не обладают такой сбалансированностью, как мыла. В основном они представляют собой или простую углеводородную цепь, или последовательно соединенны
Дата добавления: 2016-03-22; просмотров: 2038;
