Обсуждение уравнения Михаэлиса-Ментен
Сделаем еще несколько замечаний по поводу основного уравнения фер-
ментативной кинетики.
1. Параметры уравнения — Vmaxи KM.
а) Смысл величины Vmax мы уже отмечали.
 |
Это максимальная скорость, достигаемая при насыщающих концентрациях
субстрата. Согласно (20.34,б) и (20.39,б),
т.е. Vmax зависит от концентрации фермента и максимального числа оборотов отдельных молекул фермента.
б) Смысл KM таков.
I. Положим cS= KM; тогда из уравнения (20.34, а)вытекает:
 |
Следовательно, KM— такая концентрация субстрата, при которой достигается скорость реакции, равная половине максимальной.
II. Несколько упрощая, можно сказать, что KM отражает сродство фермента к
субстрату: чем это сродство выше, тем KM меньше, т.е. тем круче идет кривая
зависимости υ от cSна рис. 20.3.
в) Итак, KMхарактеризует сродство фермента к субстрату, а Vmax — активность фермента, уже связавшего субстрат.
2. Определение Vmax и KM.
а) Эти параметры обычно определяют экспериментальным путем, для чего измеряют скорость реакции при разных концентрациях субстрата.
б) Но непосредственно по графику υ(cS) трудно заключить, чему равна Vmax: не всегда ясно, к какому пределу стремится кривая. Поэтому преобразовывают уравнение Михаэлиса—Ментен к линейной форме.
в) Наиболее часто используется метод Лануйивера—Берка (или метод обратных величин):
 |

Здесь получается линейная зависимость 1/υ от 1/cS.
г) Итак, по экспериментальным данным строят график для обратных величин (рис. 20.4). И, продолжая его, находят точки пересечения с осями координат. Как видно из рис. 20.4, эти точки отсекают на оси абсцисс величину –1/KM, а на оси ординат – 1/Vmax.
3. Решение уравнения Михаэлиса–Ментен.
 |
а) Если учесть, что
 |
то уравнение Михаэлиса–Ментен — это дифференциальное уравнение относительно cS:
б) Здесь можно разделить переменные и проинтегрировать:
 |
 |
откуда
 Два первых члена правой части — это постоянная интегрирования, опре-
Два первых члена правой части — это постоянная интегрирования, опре-
деляемая из начального условия (при t = 0 cS= 0).
в) Но полученное алгебраическое уравнение является трансцендентным, и в явном виде выразить из него 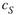 нельзя. Тем не менее, видно, что при росте t cSуменьшается, что примерно отражается графиком на рис. 20.5. Начальная часть графика близка к линейной зависимости {нулевой порядок реакции), а
нельзя. Тем не менее, видно, что при росте t cSуменьшается, что примерно отражается графиком на рис. 20.5. Начальная часть графика близка к линейной зависимости {нулевой порядок реакции), а
конечная — к экспоненциальной {первый порядок).
Краткое содержание главы 20
В главе рассмотрены цепные и каталитические реакции.
1. а) Особенностью ЦЕПНЫХ реакций является то, что среди их продуктов образуются СВОБОДНЫЕ РАДИКАЛЫ, которые вовлекают в процесс новые молекулы реагентов.
В самом процессе различают три стадии – зарождение, продолжение и обрыв цепи. Стадия продолжения состоит из повторяющихся циклов реакций (т.н. звеньев), инициирующих друг друга.
 |
б) Были приведены примеры цепных реакций, в т.ч.:
 |
в) Кинетические уравнения скорости зависят от механизма цепного процесса. В частности, для первой из приведенных реакций уравнение таково:
По мере расходования брома порядок реакции по нему возрастает от 1/2 до 3/2.
2. а) Что касается КАТАЛИТИЧЕСКИХ процессов, то даны краткие представления о ПОЛОЖИТЕЛЬНОМ и отрицательном, ГОМОГЕННОМ и ГЕТЕРОГЕННОМ катализе, АВТОКАТАЛИТИЧЕСКИХ процессах, ФЕРМЕНТАХ – биологических катализаторах белковой природы.
б) Принципиальная особенность катализа состоит в том, что катализатор не входит в суммарное уравнение реакции и увеличивает в равной степени скорость как прямой, так и обратной реакции.
в) Возможные способы действия катализаторов таковы:
- увеличение эффективной концентрации реагентов,
- повышение энергии реагентов (создание напряжения в их молекулах),
- понижение энергетического барьера (путём разбиения исходной реакции на промежуточные стадии с меньшими барьерами).
г) Для ферментативных реакций, протекающих по простейшему механизму:
 |
скорость описывается УРАВНЕНИЕМ МИХАЭЛИСА-МЕНТЕН:
 |
д) При этом КОНСТАНТА МИХАЭЛИСА, КМ , численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной (0,5 Vmax).
Значения параметров КМи Vmaxможно определить по графику зависимости 1/v от 1/cS (метод Лануйивера-Берка).
е) Интегрирование же уравнения Михаэлиса-Ментен приводит к трансцендентному алгебраическому уравнению относительно концентрации субстрата:
cS + KM∙ln cS = coS + KM∙ ln coS – Vmax .
Глава 21. КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Введение
До сих пор речь шла о кинетике лишь гомогенных процессов.
1. Теперь же обратимся к гетерогенным процессам, где реагирующие вещества находятся в разных фазах. Следовательно, в таких процессах реакция происходит на границах раздела фаз.
 2. Конкретным примером являются электродные процессы (главы 14–15) —
2. Конкретным примером являются электродные процессы (главы 14–15) —
электролиз и генерация ЭДС в гальванических элементах.
В частности, возьмем элемент из двух редокс-электродов (рис.14.3).
В левом полуэлементе взаимодействуют растворенное вещество AH2 и платина в составе твердого электрода: эти вещества обмениваются электронами.
Очевидно, сама полуреакция происходит на поверхности электрода.
То же можно сказать о правом полуэлементе.
3. Реакции на границе раздела фаз имеют определенные особенности кинетики. Эти особенности мы обсудим вначале с общих позиций (т.е. применительно к любым гетерогенным процессам), а в следующей главе — в отношении конкретных электрохимических процессов.
а) В гетерогенной реакции различают обычно не менее трех стадий:
I. перенос реагирующих веществ к поверхности раздела фаз,
II. собственно реакцию,
III. отвод продуктов реакции от поверхности.
б) Причём в основе первой и третьей стадий лежат не химические, а физико-химические процессы. Как правило, это диффузия и движение частиц в электрическом поле.
4.В частности, для приведенного выше примера стадии левой полуреакции отражаются схемой:
 |
5. а) Результирующая же скорость гетерогенной реакции определяется, очевидно, самой медленной стадией. Чаще всего такой стадией является именно диффузия.
б)Следовательно, диффузия играет очень важную роль в кинетике гетерогенных процессов. В связи с этим, остановимся на ней подробнее.
Дата добавления: 2016-03-20; просмотров: 775;
