Уравнение Михаэлиса-Ментен
Теперь обратимся к кинетике каталитических реакций. Для определенности, будем иметь в виду ферментативные реакции, хотя многое из нижеследующего справедливо и для прочих каталитических процессов.
 |
1. Как и для цепных реакций, уравнение скорости ферментативного процесса зависит от его конкретного механизма. Рассмотрим простейший случай: односубстратныв необратимые реакции вида
протекающие в две стадии:
 |
На первой (обратимой) стадии образуется фермент-субстратный комплекс ES, а на второй он необратимо распадается на фермент и продукт реакции.
2. Вывод уравнения скорости производится по тому же принципу, что и для
цепных реакций (п. 20.2).
а) Так, тоже исходят из условия стационарности. В данном случае оно означает постоянство концентрации комплекса ES:
 |
б) Заметим, что концентрация свободного фермента равна
 |
где cE,0 — общая концентрация фермента — и в свободном состоянии, и в составе комплекса ES.
 |
в) Подставляя cEв (20.29), можно найти стационарную концентрацию комплекса:
 |
Здесь введена константа Михаэлиса:
 |
г) Скорость же образования конечного продукта, а значит и скорость реакции в целом, очевидно, такова:
 |
д) Подставляя cES, получаем искомое выражение:
Величина Vmax — это максимальная скорость реакции; формула же (20.34, а) — уравнение Михаэлиса—Ментен, являющееся основным в ферментативной кинетике.
3. Проанализируем это уравнение.
 |
а) При малых концентрациях субстрата S (когда cS« KM) имеем:

т.е. фермент работает в линейном режиме, а реакция имеет первый порядок.
б) Если же, напротив, концентрация субстрата очень велика, получаем режим насыщения:

Здесь скорость перестает зависеть от концентрации субстрата, не поднимаясь выше Vmax, т.е. реакция приобретает нулевой порядок.
в) Отсюда — та гипербола, которой описывается зависимость v от 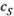 для ферментативной реакции (рис. 20.3). По мере же расходования субстрата порядок реакции изменяется от нулевого до первого.
для ферментативной реакции (рис. 20.3). По мере же расходования субстрата порядок реакции изменяется от нулевого до первого.
Дата добавления: 2016-03-20; просмотров: 651;
