Занятие 8. Равновесные статистические распределения.
Задача 7-1
Задача 04.2.1.1
Идеальный газ с γ показателем адиабаты совершает обратимый процесс со следующей зависимостью p давления от V объёма: P = P0 - αV, где p0 и α - положительные постоянные. При каком значении Vm объёма S энтропия идеальногогаза окажется максимальной и равной Smax?
Дано: γ; P =P0 - αV; S(Vm) = max/Vm = ?
|
термодинамика" S энтропии согласно параграфу "Термодинамическая энтропия для обратимого термодинамического процесса" с учётом количества ν = M/μ вещества и (1.1) имеет следующий вид: dS ={[Cv(M/μ)dT]/T} + [(M/μ)RdV]/V] = [(νR)/(γ - 1)](dT/T) + νR(dV/V). (1.2)
|
V объёма в (1.3) и получаем выражение dT дифференциала от T температуры: dT = (P0 - 2αV)dV/νR. (1.5) Делим (1.5) на (1.3) T = PV/νR c подстановкой в него P = P0 - αV и получаем следующее выражение относительного dT/T дифференциалатемпературы: dT/T = (P0 - 2αV)dV/(P0 - αV)V. (1.6) Подставляем (1.6) в (1.2) и получаем следующее выражение dS/dV первой производной
S энтропии в зависимости от V объёма: dS/dV = (νR){[(p0 - 2αV)/(γ - 1)( p0 - αV)V] + (1/V)}. (1.7) Энтропия S будет равна своей Smax максимальной величине при значении Vm объёма, когда dS/dV первая производная в (6.7) равна нулю, вследствие чего имеет место следующее выражение: dS/dV|Vm = 0 ↔ {[(p0 - 2αVm)/(γ - 1)( p0 - αVm)Vm] + (1/Vm)} = 0 ↔ Vm = γp0/α(γ - 1), м3. (1.8) Задача 04.2.1.2
Один ν = 1 моль газа Ван - дер - Ваальса, имевший V1 объём и T1 температуру, переведён в состояние с V2 объёмом и T2 температурой. Найти ΔS приращение S энтропии газа, считая известной
b константу газа Ван - дер - Ваальса, с помощью которой переходят от V' объёма сосуда, свободного от молекул газа Ван - дер - Ваальса, к V объёму газа Ван - дер - Вальса, а также считая известной
CV молярную теплоемкостьпри постоянном V объёме этого газа Ван - дер - Вальса.
Дано: ν; V1; T1; V2; T2; CV/ ΔS = ?
Свободный (рис. 04.2.1.2) от молекул V1′, V2′ объёмы, т.е. объёмы (4.110) из раздела 04.1.0 "Физическая термодинамика" идеального газа, эквивалентного по своим свойствам ван - дер -
ваальсовскому газу и с соответственно P1, P2 давлением на стенки сосуда и V1, V2 объёмом в
1-ом состоянии и во 2-ом состоянии с учётом ν = 1 моль количества газа имеет следующий вид:
V1′ = V1 - b; V2′ = V2 - b. (2.1)
Приращение ΔS = S2 - S1 энтропии идеального газа, эквивалентного по своим свойствам ван - дер - ваальсовскому газу, при переходе в обратимом процессе из (рис. 04.2.1.2) 1-ого состояния во
2-ое состояние согласно (4.155) из раздела 04.1.0 "Физическая термодинамика" имеет следующий вид: ΔS = ν[CVln(T2/T1) + Rln(V2′/V′1)]. (2.2) Подставляем (2.1) V1′, V2′ объёмы идеального газа, эквивалентного по своим свойствам ван - дер
|

Задача 04.2.1.3
Плотность ρ смеси He гелия и N2 азота при нормальных условиях имеет значение: ρ = 0,60 г/л. Найти nHe концентрацию молекул He гелия в этой смеси. Дано: ρ, p0, T0, mHe, mN2/nHe = ?
Плотности ρHe гелия He, ρN2 азота N2 c учётом масс их молекул соответственно mHe, mN2, а также с учётом концентраций nHe, nN2 этих молекул имеют следующий вид: ρHe = nHemHe; ρN2 = nN2mN2.(3.1) Согласно закону Дальтона ρ плотность смеси He гелия и N2 азота равна сумме плотностей каждого из этих газов в отдельности, из чего с учётом (3.1) получаем следующее выражение
nN2 концентрацию молекул азотав этой смеси:
ρ = ρHe + ρN2 = nHemHe + nN2mN2 ↔ nN2 = (ρ - nHemHe)/mN2.(3.2) Парциальные PHe, PN2 давления соответственно молекул с nHe, nN2 концентрациями соответственно He гелия и N2 азота в смеси этих газов согласно основному (4.30) из раздела 04.1.0 "Физическая термодинамика" уравнению молекулярно - кинетической теории при T0 нормальной температуре окружающей среды с учётом k = 1,38·10-23 Дж/K постоянной Больцмана имеют следующий вид : PHe = nHekT0; PN2 = nN2kT0. (3.3) Согласно закону Дальтона P0 нормальное давлениесмеси равна сумме PHe, PN2 парциальных (3.3) давлений соответственно He гелия и N2 азота, вследствие чего имеет место следующее выражение: P0 = PHe + PN2 ↔ nN2kT0 = P0 - nHekT0. (3.4) Подставляем (3.2) nN2 концентрацию молекул азота в (3.4) и получаем следующее выражение
nHe концентрациb молекул He гелия в его смеси с N2 азотом: (ρ - nHemHe)kT0/mN2 = P0 - nHekT0 ↔ nHe = [(P0/kT0) - (ρ/mN2)]/[1- (mHe/ mN2)], 1/м3, (3.5) где ρ - плотность смеси He гелия и N2 азота при её P0 нормальном давлении и T0 нормальной температуре окружающей среды.
Задача 04.2.1.4
Во сколько k раз надо расширить адиабатически идеальный газ, состоящий из жёстких двухатомных молекул, чтобы их vкв средняя квадратичная скорость уменьшилась в η = 1,5 раза.
Дано: vкв1/vкв2 = η; k = ?
Отношение vкв1,vкв2 средних квадратичных скоростей согласно (4.34) из раздела 04.1.0 "Физическая термодинамика" с учётом μ молярной массы идеального газа при T1, T2 температурах соответственнои условия задачи имеет следующий вид:
η = vкв1/vкв2 = (3RT1/ μ)1/2/(3RT2/ μ)1/2 = (T1/T2)1/2 ↔ T1/T2 = η2. (4.1) Уравнение Пуассона (4.68) из раздела 04.1.0"Физическая термодинамика" в параметрах
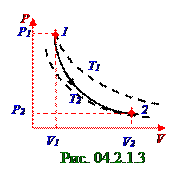
P давления и V объёма (рис. 04.2.1.3) в 1-ом состоянии и во 2-ом состоянии с учётом cвязи (4.67) из раздела 04.1.0 "Физическая термодинамика" γ показателя адиабаты с i = 5 количеством степеней свободы жёстких двухатомных молекул идеального газа имеет следующий вид:
P1V1γ = P2V2γ ↔ P1V1(i + 2)/i = P2V2(i + 2)/i ↔ P1/P2 =( V2/V1) (i + 2)/i. (4.2) Уравнение (4.13) из раздела 04.1.0"Физическая термодинамика" Клапейрона - Менделеева газа с учётом постоянства ν количества этого газа при переходе из 1-ого состояния с V1 объёмом и
T1 температурой во 2-ое состояние с V2 объёмом и T2 температурой имеет следующий вид: P1V1/T1 = P2V2/T2 ↔ P1/P2 = (V2/V1) T1/T2. (4.3) Подставляем (4.1) в (4.3) и получаем следующую связь P1/P отношения давлений во 2-ом состоянии и в 1-ом состоянии идеального газа с (vкв1/vкв2)2 = η2 квадратом отношения vкв средних квадратичных скоростей жёстких двухатомных молекул: P1/P2 = (V2/V1)η2. (4.4)
|
Задача 04.2.1.5
Найти δN/N относительное число молекул идеального газа, v модули векторов v скоростей которых отличаются не более, чем на δη = 1% от значения: а) наиболее vвер вероятной скорости;
|
попадания заданных значений v модулей векторов v скоростей молекул идеального газа, имеющего
T температуру, без учёта направлений их движения в единичный интервал измерений, например, равна вероятности попадания v модулей векторов v скоростей молекул идеального газа в интервал
100…101 м/с значений.
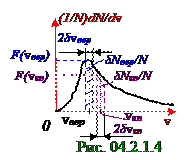
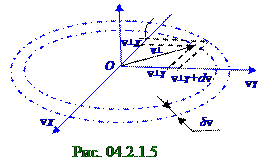
Количество δNвер молекул, v модули векторов v скоростей которых отличаются не более, чем на δη = 1% от наиболее vвер вероятного значения скорости, есть большое число, поэтому его отношение к полному N числу молекул в данной массе газа равняется согласно (4. 219) из раздела 04.2.0 "Физическая термодинамика" δP(vi) вероятности события попадания v модулей векторов v скоростей молекул идеального газа в интервал 2δvвер (рис. 04.2.1.4) скоростей.
Интервал 2δvвер скоростей по отношению к vвер вероятной скорости составляет 0,02 части, т.е. малую величину, поэтому приближённое значение δP(vi) вероятностисобытия попадания v модулей векторов v скоростей молекул идеального газа в 2δvвер интервал скоростей равно (рис. 04.2.1.4) площади прямоугольника под графиком (1/N)dN/dv плотности вероятности v модулей векторов v скоростей молекул идеального газа с высотой, равной F(vвер) ординате, и шириной, равной 2δvвер интервалу этих скоростей. Приближённое значение δP(vi) вероятностисобытия попадания v модулей векторов
v скоростей молекул идеального газа в 2δvвер интервал скоростей согласно (4.267) из раздела 04.2.0 "Физическая термодинамика" и с учётом (5.1) имеет следующий вид: δP(vi) = δNвер/N ≈ F(vвер)2δvвер = 2(m/2πkT)3/2 exp(-mv2/2kT) 4πv2 δvвер. (5.2) Для решения а) пункта условия задачи, а именно: найти δN/N относительное число молекул идеального газа, v модули векторов v скоростей которых отличаются не более, чем на δη = 1% от значения наиболее vвер вероятной скорости, в выражении (5.2) следует учесть, что v есть модуль векторов v скоростей молекул идеального газа, мало отличающихся от vвер вероятной скорости, поэтому этот v модуль векторов v скоростей молекул идеального газа можно заменить на vвер вероятную скорость, которая согласно (4.269) из раздела 04.2.0 "Физическая термодинамика" имеет следующий вид: v = vвер = (2kT/m)1/2. (5.3) Связь δvвер абсолютных отклонений v модулей векторов v скоростей молекул идеального газа относительно vвер вероятной скорости с их δη относительным отклонением имеет следующий вид: δη = δvвер/vвер ↔ δvвер = δηvвер = (2kT/m)1/2δη. (5.4) Подставляем (5.3), (5.4) в (5.2) и получаем следующее выражение (рис.5.1) δNвер/N относительного числа молекул идеального газа, v модули векторов v скоростей молекул идеального газа которых отличаются не более, чем на δη = 1% от значения vвер вероятной скорости: δNвер/N = [8/(π)1/2]e-1δη. (5.5) Для решения б) пункта условия задачи, а именно: найти δN/N относительное число молекул идеального газа, v модули векторов v скоростей которых отличаются не более, чем на δη = 1% от значения средней vкв квадратичной скорости, в выражении (5.2) следует учесть, что v есть модуль векторов v скоростей молекул идеального газа, мало отличающихся от vкв квадратичной скорости, поэтому этот v модуль векторов v скоростей молекул идеального газа можно заменить на vкв квадратичную скорость, которая согласно (4.34) из раздела 04.1.0"Физическая термодинамика" имеет следующий вид: v = vкв = (3kT/m)1/2. (5.6) Связь абсолютных δvкв отклонений v модулей векторов v скоростей молекул идеального газа относительно vкв среднейквадратичной скорости с их δη относительным отклонением имеет следующий вид: δη = δvкв /vкв ↔ δvкв = vквδη = (3kT/m)1/2δη. (5.7) Подставляем (5.6), (5.7) в (5.2) и получаем следующее выражение относительного (04.2.1.4) δNкв/N числа молекул идеального газа, v модули векторов v скоростей которых отличаются не более, чем на δη = 1% от значения средней vкв квадратичной скорости: δNкв/N = 12(3/2π)1/2 e-3/2δη. (5.8)
Задача 04.2.1.6
|
 |
интервале значений скоростей по OvX оси координат v┴X проекций на эту OvX ось вектора v┴ скоростей молекул, находящихся в OvX, OvY плоскости, имеет следующий вид:
f (v┴X) = (m/2πkT)1/2exp(-mv┴X 2/2kT ). (6.1)
Функция (4.260) из раздела 04.2.0 "Физическая термодинамика" f(v┴Y) плотности вероятности, которая численно равна вероятности нахождения в единичном интервале значений скоростей по
OvY оси координат v┴Y проекций на эту OvY ось вектора v┴ скоростей молекул, находящихся в OvX, OvY плоскости, имеет следующий вид: f (v┴Y) = (m/2πkT)1/2exp(-mv┴Y 2/2kT ). (6.2)
Cовместная (4. 228) из раздела 04.2.0 "Физическая термодинамика" f (v┴X, v┴Y ) функция плотности вероятности, которая численно равна вероятности одновременного нахождения в единичном интервале значений скоростей по OvX, OvY осям координат v┴X, v┴Y проекций на эти OvX, OvY оси вектора v┴ скоростей молекул, находящихся в OvX, OvY плоскости, имеет (6.1), (6.2) с учётом статистической независимости v┴X и v┴Y проекций скоростей молекул идеального газа m массой следующий вид: f(v┴X, v┴Y ) = f (v┴X)f (v┴Y) = (m/2πkT)exp[-m(v┴X 2+ v┴Y 2) /2kT] =
= (m/2πkT)exp(-mv┴2/2kT), (6.3) где v┴ = (v┴X 2+ v┴Y 2)1/2 - заданное значение модуля вектора v┴ скорости молекулы идеального газа, перпендикулярного в пространстве скоростей OvZ оси.
Относительное число δN/N молекулидеального газа m массой, v┴ модуль вектора v┴ скоростей которых, находящихся в OvX, OvY плоскости, имеет значения v┴ - (δv/2) ≤ v┴ ≤ v┴ + (δv/2) равно с учётом (6.3) следующей величине δP(v┴X, v┴Y ) вероятности:
δP(v┴X, v┴Y ) = δN/N = f(v┴X, v┴Y )2πv┴δv = (m/2πkT)exp(-mv┴2/2kT) 2πv┴δv =
= (m/kT)exp(-mv┴2/2kT)v┴δv, (6.4) где 2πv┴δv - площадь кольца (рис. 04.2.1.5) в OvX, OvY плоскости скоростей; N - полное число молекул m массой в объёме идеального газа T температурой, в которой измеряются скорости молекул;
v┴ - заданное значение модуля вектора v┴ скорости молекулы идеального газа, перпендикулярного в пространстве скоростей OvZ оси.
Задача 04.2.1.7
|
|
Ответ: ηdφ = nк(2kT/πm)1/2sinφcosφdφ, η0 = nк<v>/4, где <v>= (8kT/πm)1/2 - среднее арифметическое значение vi модулей вектора vi скоростей молекул; k = 1,38·10-23 Дж/K - постоянная Больцмана. Дано: φ; dφ; T; nк; m/ηdφ =? η0 =?
Направим OY ось вправо и Ст стенку расположим под φ углом к OY оси, вследствие чего схема задачи 04.2.1.9 примет вид на рис. 04.2.1.7.
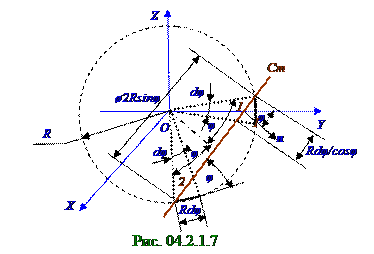
Площадь dS кольца (рис. 04.2.1.7) шириной Rdφ/cosφ, образованного пересечением Ст стенки со сферой R = 1 ед. радиусом и имеющей φ угол n нормали к поверхности Ст стенки с OY осью, имеет следующий вид: dS = 2πR2sinφdφ/cosφ.(9.1)
Телесный угол dΩ - это площадь сферы, которую "вырезают" R = 1 ед. радиусы, между которыми dφ угол, имеет с учётом (9.1) следующий вид: dΩ = dScosφ = 2πsinφdφ.(9.2)
|
f(vY)=(m/2πkT)1/2exp(-m vY 2/2kT) - плотность вероятности проекций viY на OvY ось vi вектора скоростей молекул.
Количество dηdφ столкновений в единицу времени на единицу площади ( 9.4) dN молекул, векторы vi скоростей которых направлены по OY оси c величиной проекций viY на OvY ось
в диапазоне viY … viY + dvi значений, имеет следующий вид:
dηdφ= nкΩ0 f(vY)cosφ vYdvY = nк(sinφcosφdφ/2)(m/2πkT)1/2exp(- mvY 2/2kT)vYdvY,( 9.5)
где cosφ учитывает (рис. 04.2.1.7) возрастание площади, о которую ударяются молекулы, в 1/cosφ раз, поэтому количество ударов молекул в единицу времени на единицу площади уменьшается в cosφ раз.
Общее количество ηdφ столкновений в единицу времени на единицу площади ( 9.4) N молекул, векторы vi скоростей которых направлены по OY оси c величиной проекций viY на OvY ось
в диапазоне 0 … ∞ значений, имеет с учётом (9.5) следующий вид:
vY2 → ∞ ∞
ηdφ= ∫dηdφ= nк(sinφcosφdφ/2)(m/2πkT)1/2∫exp(- mvY 2/2kT)vYdvY = nк(kT/8πm)1/2(sinφcosφdφ),( 9.6)
vY1 = 0 0
∞
где ∫exp(- mvY 2/2kT)vYdvY рассчитан с помощью подстановки: mvY 2/2kT = z ↔ vY = (2kT/m)1/2(z)1/2 ↔
0 ∞
↔ dvY = (2kT/m)1/2(1/2) (z) -1/2 ↔ z1 = 0; z2 → ∞ ↔(2kT/m)1/2(2kT/m)1/2(1/2) ∫exp(-z)(z)1/2(z) -1/2dz = kT/m.
0
Под углами (рис. 04.2.1.6), значения которых находятся в φ… φ + dφ диапазоне, ударяются о
Ст стенку одновременно молекулы, находящиеся с четырёх сторон, две 1, 2 из которых изображены рис. 04.2.1.7, а две другие находятся в плоскости, перпендикулярной Ст стенке и OYZ плоскости. Поэтому ηdφ0 общее количество молекул, падающих в единицу времени на единицу площади под
φ… φ + dφ углами (рис. 04.2.1.6) относительно n нормали к поверхности Ст стенки, имеет с учётом
(9. 6) следующий вид: ηdφ0 = 4ηdφ= 4nк(kT/8πm)1/2(sinφcosφdφ) = nк(2kT/πm)1/2(sinφcosφdφ).( 9.7)
Количество η0 соударений всех молекул (рис. 04.2.1.6) в единицу времени на единицу площади о Ст стенку, имеющих углы падения относительно n нормали к поверхности Ст стенки в диапазоне
0 … π/2 значений, т.е. всех молекул, падающих в единицу времени на единицу площади под всеми возможными углами, имеет с учётом (9. 7) следующий вид:
φ2 = π/2 π/2
η0 = ∫ηdφ0 = nк(2kT/πm)1/2 ∫ sinφcosφdφ = (nк/2)(2kT/πm)1/2 = (nк/4)(8kT/πm)1/2= (nк/4)<v>,( 9.6)
φ1 = 0 0
где <v> = (8kT/πm)1/2 - среднее арифметическое значение vi модулей вектора vi скоростей молекул (4.268) из раздела 04.2.0 "Физическая термодинамика".
| <== предыдущая лекция | | | следующая лекция ==> |
| Статистическое описание равновесных состояний термодинамических систем: одно -, дву – и трехмерные функции распределения 6 страница | | | Занятие 8. Равновесные статистические распределения |
Дата добавления: 2016-02-14; просмотров: 1155;
