Основные принципы классификации химических элементов
Все живые организмы на 99% состоят из 12 наиболее распространенных элементов, среди которых С, О, Н, N, Са и др., называемые макроэлементами. Это «структурные» элементы, присутствие которых в живой материи связано в первую очередь с их значительным содержанием в биосфере.
Стабильность химического состава организма является одним из важнейших и обязательных условий его нормального функционирования. Отклонения в содержании химических элементов, вызванных различными причинами, приводят к широкому спектру нарушений в состоянии здоровья человека.
Таблица 2. Классификация химических элементов, основанная на их массовой доле
в организмах млекопитающих.
| Порядок содержания | Массовая доля элементов (%) | Элементы | Группа |
| 100 10-2 10-3 | 1 – 9 0,1 – 0,9 0,01 – 0,09 | Ca P, K, Na, S, Cl Mg | Макроэлементы (МаЭ) |
| 10-4 10-5 10-6 | 0,001 – 0,009 0,0001 – 0,0009 0,00001 – 0,00009 | Fe, Zn, F, Sr, Mo, Cu Br, Si, Cr, I, Mn, Al, Pb Cd, B, Rb,Au | Микроэлементы (МЭ) |
| 10-7 и ниже | 0,000001 -0,000009 | Se, Co, V, Cr, As, Ni, Li Ba, Ti, Ag, Sn, Be, Ga, Ge, Hg, Sc, Zr, Bi, Sb, U, Th, Rh. | Ультрамикроэлементы |
Во всех организмах находится небольшое количество (менее 0,3 %) более тяжелых элементов, которые условно подразделяются на микро- и ультрамикроэлементы: 81 элемент обнаружен в организме человека. При этом 15 из них (железо (Fe), йод (I), медь (Сu), цинк (Zn), кобальт (Со), хром (Сг), молибден (Мо), никель (Ni), ванадий (V), селен (Se), марганец (Мn), мышьяк (As), фтор (F), кремний (Si), литий (Li)) признаны эссенциальными, т.е. жизненно необходимыми. Железо, медь, марганец, йод, цинк, хром, селен, молибден, кобальт выполняют каталитическую и регуляторную функции и участвуют во всех видах обмена веществ. Четыре других (кадмий (Cd), свинец (Рb), олово (Sn), рубидий (Rb)) являются «серьезными кандидатами на эссенциальность».
Таблица 3. Классификация, основанная на биологической роли элементов
| Жизненно необходимые элементы | Вероятно необходимые элементы | Элементы с малоизученной ролью | ||
| Кальций | Сера | Фтор | Литий | Бериллий |
| Фосфор | Магний | Кремний | Бор | Скандий |
| Калий | Железо | Титан | Алюминий | Галлий |
| Хлор | Медь | Ванадий | Германий | Рубидий |
| Натрий | Кобальт | Хром | Цирконий | Серебро |
| Цинк | Никель | Олово | Сурьма | |
| Марганец | Мышьяк | Цезий | Барий | |
| Молибден | Бром | Ртуть | Свинец | |
| Йод | Стронций | Висмут | Радий | |
| Селен | Кадмий | Торий | Уран |
МЭ или «следовые вещества» играют большую роль не только в физиологических процессах, но также участвуют в развитии патологических процессов и формировании защитной реакции организма.
Распределение МЭ в органах и жидкостях человека неравномерно. Мышьяк, сурьма, барий, бериллий, висмут, бор, свинец, таллий имеют репутацию токсичных элементов и содержатся в органах и тканях организма человека в малых количествах. Ряд токсичных МЭ по неизвестной пока причине присутствует в отдельных органах в относительно больших количествах. В частности, необъяснимо высоко содержание золота в головном мозге и в почках (0,0025 ммоль/кг сухой массы), высоко содержание бора в почках (0,0462 ммоль/кг) и в печени (0,0444 ммоль/кг). Известная из-за своей токсичности ртуть содержится во всех изученных органах, причем в головном мозге ее концентрация достигает 0,014 ммоль/кг; еще выше — в печени (0,018ммоль/кг). Содержание таллия, так же обладающего токсическим свойством, во всех органах находится почти на одном уровне (0,002 ммоль/кг), а в головном мозге достигает 0,0024 ммоль/кг. Содержание олова необычно высоко в головном мозге (0,0168 ммоль/кг), что на порядок превышает соответствующие показатели в сердце и почках.
Условно разделяют МЭ на три группы:
1) Катионные элементы,находящиеся в организме в виде положительно заряженных ионов электролитов - это цинк, железо, марганец и медь.
2) Анионные элементы,находящиеся в организме в виде отрицательно заряженных ионов электролитов - это хром, селен, молибден, йод.
3) Элементы, существующие в виде органических комплексов,в которых они выполняют роль комплексообразователя.
Элементы из одной группы могут переходить в другую в ходе химических процессов, протекающих в организме, при этом происходит изменение их валентности (степени окисления) и взаимодействие с возможными лигандами.
Изучение механизмов абсорбции и элиминации МЭ приносит все новые доказательства участия в них регулирующих систем организма — нервной, эндокринной и иммунной. Содержание МЭ в крови, как правило, очень невелико, но может характеризовать патологию внутренних органов. Так, уровень свинца в крови у детей примерно равен содержанию этого МЭ у взрослых, однако, для детей европейских стран содержание свинца в крови считается угрожающим здоровью, если оно превышает 0,0012 ммоль/л, для взрослых мужчин эта концентрация составляет 0,0019ммоль/л и для женщин — 0,0015 ммоль/л.
Организм здорового человека обладает достаточно четкой саморегулирующей системой, поддерживающей внутреннее равновесие (гомеостаз), в которой уровень микроэлементов в крови и тканях подчиняется определенным физиологическим закономерностям.
Большинство МЭ представляют собой d-металлы, которые образуют комплексные соединения с аминокислотами, карбоновыми кислотами, нуклеиновыми кислотами, нуклеотидами, пептидами, белками, жирными кислотами и т. д. Устойчивость данных комплексов зависит от ряда факторов: природы растворителя и лигандов, кинетической природой комплексообразования , принципами комплементарности и стереоселективности.
9.2. Комплексные соединенияхарактеризуются образованием ковалентных связей, образованных по донорно-акцепторному механизму за счет электронной пары одного атома и вакантной электронной орбитали другого. Такая ковалентная связь называется координационной связью. Самым простым координационным соединением, известным из школьного курса химии, является хлорид аммония.
В живых организмах комплексные соединения представлены соединениями металлов Mo, Fe, Co, Cu, Mn, Mg, Zn с белками, витаминами и другими соединениями, участвующими в процессах жизнедеятельности.
Согласно ныне принятой теории строения комплексных соединений (А. Вернер, 1893 г) в центре комплексного соединения находится комплексообразователь – атом или ион, присоединяющий к себе молекулы или противоположно заряженные ионы. Эти ионы или молекулы координируются вокруг комплексообразователя и называются лигандами. Лиганды вместе с 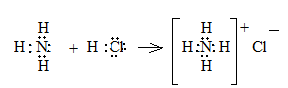 комплексообразователем образуют комплексный ион или внутреннюю (координационную) сферу, которая изображается в квадратных скобках. Число лигандов называется координационным числом. Ионы, имеющие противоположный комплексному иону заряд, образуют внешнюю сферу координационного соединения. Например, для хлорида аммония: N (атом азота) – комплексообразователь, Н – лиганд, NН4+ - комплексный ион аммония, Cl¯ -образует внешнюю сферу.
комплексообразователем образуют комплексный ион или внутреннюю (координационную) сферу, которая изображается в квадратных скобках. Число лигандов называется координационным числом. Ионы, имеющие противоположный комплексному иону заряд, образуют внешнюю сферу координационного соединения. Например, для хлорида аммония: N (атом азота) – комплексообразователь, Н – лиганд, NН4+ - комплексный ион аммония, Cl¯ -образует внешнюю сферу.
Комплексообразователем может быть любой элемент периодической системы, но чаще комплексообразователями являются d – элементы (Fe, Co, Cu и др.), s- и p- элементы реже.
В качестве примера образования комплексного соединения рассмотрим реакцию:
FeCl3 + 6KCN → K3[Fe(CN)6] + 3 KCl
K3[Fe(CN)6] – гексацианофаррат калия. Комплексообразователь - ион Fe+3, координирующий вокруг себя 6 лигандов CN¯. Квадратными скобками выделен комплексный ион [Fe(CN)6]3-, внешняя сфера образована ионами К+.
Другим известным примером комплексного соединения является белок крови - гемоглобин. В центре этого комплекса находится комплексообразователь - ион Fe+2, координирующий вокруг себя 6 других лигандов сложной органической и неорганической природы.
Пространственную структуру комплексного соединения, где М+2 –ион комплексообразователя, можно представить следующим образом: 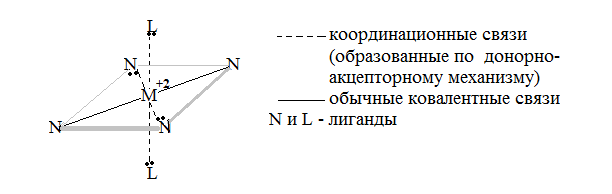
Необходимо отметить, что существует взаимное влияние лигандов и центрального атома. Образование донорно - акцепторной связи приводит к изменению электронной конфигурации атомов, и, следовательно, к изменению их свойств. Так, например, известно, что стандартный электродный потенциал водного раствора окислительно - восстановительной системы Fe3+ / Fe2+ (Pt) равен +0,771 В. Стандартный электродный потенциал окислительно – восстановительной системы, образованной цианидными комплексами железа в тех же степенях окисления [Fe(CN)6]4- /[Fe(CN)6]3- (Pt) на много меньше и равен +0,36 В.
В заключении курса лекций по химии необходимо сказать, что современная медицина, в том числе и стоматология, для своего развития и понимания причин протекающих в организме процессов, использует гораздо более широкий круг разделов химической науки, чем изложенные выше в данном курсе.
Дата добавления: 2016-03-15; просмотров: 1429;
