Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются электродными потенциалами.
Для расчета величины электродного потенциала (е), Нернстом было предложено уравнение:
e = eo + RT ln a Met n+
nF
e - электродный потенциал , В
Т – абсолютная температура, К.
R = 8,313 Дж/моль
F – число Фарадея ( 96485 кулонов/моль)
n – зараяд катиона.
eо - стандартный (нормальный) электродный потенциал, В.
Он возникает на металле, погруженном в раствор собственной соли, с активностью катионов в растворе 1 моль/л.
a Met n+ - активность катионов металла (эффективная концентрация).
Однако, для расчетов основных физико-химических величин, приведенная форма уравнения неудобна. С учетом величин всех постоянных и при температуре 25оС (298К), используют уравнение:
e = eo + 0,059 lg a Met n+
n
Анализ уравнения показывает, что величина и знак электродного потенциала зависит от соотношения величин слагаемых этого уравнения: активности ионов металла (lg a Met n+ ) и от его природы (eo).
Для того чтобы, можно было сравнить электродные потенциалы, возникающие в различных электродах, необходимо выбрать точку отсчета. За такую точку приняли потенциал водородного электрода, величину которого считают равной 0. На основе этого, построен ряд стандартных электродных потенциалов металлов (ряд активности металлов):
Li К Са Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Li+ K+ Ca2+ Nа+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+ Pt2+ Au3+
-3,01 -2,92 - 2,87 -2,71 -2,37 -1,66 -0,76 -0,44 -0,14 -0,13 0 +0,34 +0,79 +0,80 +1,2 +1,5В.
Убывание восстановительной активности металлов
Анализируя ряд стандартных электродных потенциалов, можно сделать следующие выводы:
1. У металлов, стоящих в начале ряда (активные металлы), преобладает процессрастворения, т.е. окисления металла. Металл, погруженный в раствор соли заряжается отрицательно.
2. У металлов, стоящих в конце ряда, преобладает процесс осаждения на металлическую пластинку, т.е. восстановления из раствора. Металл, погруженный в раствор соли заряжается положительно.
3. Любой более активный металл, погруженный в раствор своей соли, приобретает меньший по величине потенциал по сравнению с менее активным металлом.
 8.5. Гальванические элементы
8.5. Гальванические элементы
Гальванические элементы – это системы, состоящие из двух электродов, в которых энергия химических реакций превращается в электрическую энергию.
Различают 2 вида гальванических элементов:
Биметаллические элементы – системы, состоящие из двух различных электродов.
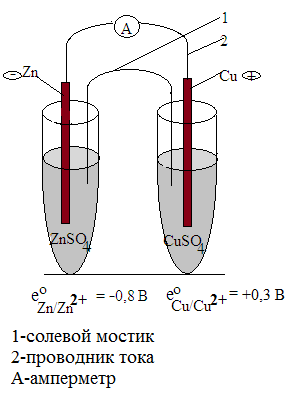
Примером такого гальванического элемента является медно-цинковый гальванический элемент (Якоби-Даниэля). В соответствии с рядом напряжений металлов цинк зарядится отрицательно, а медь положительно. При замыкании внешней цепи, в ней возникнет электрический ток, причем электроны с цинковой пластинки будут переходить на медный электрод, присоединяясь к осаждающимся на нем катионам меди. Таким образом, цинковый электрод будет анодом, т.к. на нем проходит процесс окисления цинка, а медный электрод будет катодом, т.к. на нем происходит восстановление меди. Растворы ZnSO4 и CuSO4 связаны «солевым мостиком». Солевой мостик – это стеклянная U-образная трубочка, наполненная агар-агаром, набухшим в насыщенном растворе КСl .
Каждая электродная пара имеет три характеристики:
Схема элемента: Zn/ Zn2+ // Cu/ Cu2+
Солевой мостик в схеме имеет условное обозначение - две наклонных черты.
Химическая реакция, протекающая в нем:
Анод: Zn – 2ē → Zn2+ - процесс окисления
Катод: Cu2+ + 2ē → Cu - процесс восстановления.
Zn + Cu2+ → Zn2+ +Cu - суммарная химическая реакция.
ЭДС любого элемента – это разность электродных потенциалов катода и анода:
Е = ек - еа = е Cu/ Cu2+ - е Zn/ Zn2+
Используем уравнение Нернста для расчета электродных потенциалов (n=2):
Е= (ео Cu/ Cu2+ + 0,059 lg a Cu+2 ) - (ео Zn/ Zn2+ + 0,059 lg a Zn+2 )
n n
Преобразуем полученное уравнение, учитывая выражение для стандартной ЭДС:
Е0= еоCu/ Cu2+ - ео Zn/ Zn2+
Получим уравнение для расчета ЭДС гальванического элемента:
E = Е0 + 0,059 lg aCu+2
 n aZn+2
n aZn+2
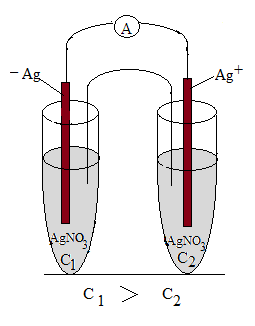
Изометаллические (концентрационные) элементы – это системы, состоящие из двух одинаковых электродов, погруженных в растворы одинаковых солей, но разной концентрации. Как было показано выше, при мѐньшей концентрации соли преобладает процесс окисления металла (по правилу Ле-Шателье), а при бóльшей концентрации соли растворе преобладает процесс восстановления катионов металла из раствора: первый электрод будет анодом, а второй электрод будет катодом.
Характеристики элемента:
1. Схема элемента:
Анод Ag/ Ag+(C1) // Ag/ Ag+(C2) Катод
С1 ˃ С2
2. Электродная химическая реакция:
Анод: Ag – ē → Ag+ - процесс окисления
Катод: Ag+ + ē → Ag - процесс восстановления
Ag +Ag+ → Ag+ + Ag - суммарная реакция
3. Расчет ЭДС элемента с учетом уравнения Нернста:
Е = ек - еа
еAg/Ag+ = еоAg/Ag+ + 0,059 lg aAg+
n
Пренебрегая коэффициентом активности (f) при расчете эффективной концентрации (активности) ионов Ag+ (aAg+) и учитывая, что n = 1, получим уравнение для расчета ЭДС изометаллического элемента:
Е = 0,059 lg С1 / С2
Дата добавления: 2016-03-15; просмотров: 3467;
