Проводники второго рода, явления, связанные с перемещением ионов
Растворы электролитов – это проводники второго рода. В них электрический ток обусловлен перемещением заряженных частиц (ионов) под действием приложенной разности потенциалов. В таких системах наблюдаются два типа явлений:
1. Явления, связанные только лишь с перемещением ионов (заряженных частиц) в растворе;
2. Явления, где изменяется механизм переноса электричества, так, называемые электродные процессы.
Сейчас будет рассмотрена первая группа явлений, а электродные процессы будут рассмотрены в разделе «электрохимия».
Способность растворов электролитов проводить электрический ток называется электропроводностью (L). Электропроводность – это величина, обратная сопротивлению проводника электрического тока R:
L = 1/ R , [L]= ом-1
Сопротивление проводника электрического тока R пропорционально длине проводника и обратно пропорционально площади поперечного сечения проводника: l
R = ρ
S
ρ - удельное сопротивление, т.е. сопротивление проводника с длиной l =1 м и площадью сечения S =1 м2 (как видно, объем такого проводника 1 м3). Таким образом, единицы измерения [ρ]= Ом*м.
Величина, обратная удельному сопротивлению называется удельной электропроводностью (χ - «капа»):
χ = 1/ρ ,т.е. [χ]= Ом-1*м-1
Очевидно, что электропроводность раствора зависит от концентрации ионов, но зависимость эта сложная: с увеличением концентрации ионов увеличивается количество носителей заряда, но с другой стороны, усиливается электростатическое взаимодействие, снижающее скорость их движения, а следовательно, и их способность проводить электрический ток, поэтому на графике (см. рис.χ =f(С)) представлена экстремальная зависимость, проходящая через maximum. 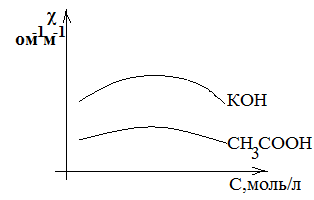
Кроме этого, удельная электропроводность зависит и от скорости движения ионов, которая обусловлена:
1. Разной природой ионов (их размером, зарядом, степенью гидратации);
2. Разной природой растворителя (его диэлектрической проницаемостью, вязкостью);
3. Различными внешними условиями (например, температурой). Известно, что повышение температуры раствора на 1оС увеличивает величину удельной электропроводности на 2 – 2,5 % вследствие уменьшения вязкости раствора.
Для устранения двойственного (экстремального) влияния концентрации электролита на электропроводность его раствора, вводят понятие эквивалентной электропроводности (λ -«лямбда»), т. е. электропроводности раствора, приведенной к единичной его концентрации.
Эквивалентная электропроводность раствора – это электропроводность раствора, содержащего один эквивалент электролита в 1 м3 раствора, и поэтому для каждого конкретного раствора, может быть легко определена по формуле:
λ v = 1000 χ / СN ;[λ] = ом-1*м2*экв-1
 λ v– эквивалентная электропроводность при данной концентрации раствора,
λ v– эквивалентная электропроводность при данной концентрации раствора,
СN – нормальная концентрация раствора.
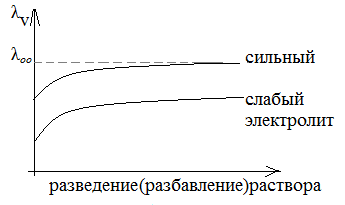
С уменьшением концентрации раствора (с увеличением разведения раствора) (см. рис.λv= f(разведение)) эквивалентная электропроводность достигает предельного значения при бесконечном разведении раствора (λ оо).
Таким образом, эквивалентная электропроводность при бесконечном разведении (λ∞) зависит только от скорости движения ионов.
Закон Кольрауша.
Было установлено, что при бесконечном разведении катионы и анионы электролитов движутся и, следовательно, проводят электрический ток независимо друг от друга: λ оо = λ к + λ а
Это утверждение носит название закон Кольрауша.В этом законе величиныλ к и λ а имеют смысловое значение подвижностей катиона и аниона, соответственно. Они измеряются экспериментально в единицах эквивалентной электропроводности:
λ к = F * Uk ; λ а = F * Ua
F - число Фарадея (96480 кулонов)
Uk и Ua - абсолютные скорости движения катиона и аниона, соответственно.
Дата добавления: 2016-03-15; просмотров: 1277;
