Под абсолютной скоростью движения ионов принимают величину пути, пройденного ионом за единицу времени в электрическом поле с напряжением 1 В.
Полученные значения эквивалентных электропроводностей растворов при различных концентрациях, позволяют определить степени диссоциации (α) любых электролитов по формуле:
λ v
α=
λ оо
Изученные явления находят широкое применение и в медицинской практике.
Ткани и жидкости организма содержат значительное количество электролитов и поэтому обладают довольно высокой электропроводностью. Электрический ток, проходя через организм, оказывает на него электрохимическое, электромеханическое и биологическое действие. На этом основаны различные методы лечения.
Например, лекарственный электрофорез – это метод введения лекарственных препаратов в ионизированном виде через кожные покровы и слизистые оболочки тела под действием постоянного электрического тока.
Другой пример: дарсонвализация – метод лечения импульсным током высокой частоты и напряжения, но малой силы. При проведении дарсонвализации изменяются физико-химические и обменные процессы в тканях, улучшается деятельность ЦНС.
8.3. Электрохимия.Электрометрические методы анализа.
Электрохимия - это раздел физической химии, изучающий превращение химической энергии в электрическую энергию, и наоборот. Определение различных физико-химических величин, характеризующих процессы превращения энергий, проводят с помощью электрометрических методов анализа. Они основаны на измерении электродвижущей силы (ЭДС) – разности потенциалов, возникающих в растворах. В биохимических исследованиях эти методы широко используются для определения концентраций биологических жидкостей, активности ионов, определение рН мутных и окрашенных растворов, определения биопотенциалов.
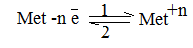 Для изучения механизма возникновения ЭДС, рассмотрим процессы, которые будут проходить в системе, созданной при погружении какой-либо металлической пластинки в раствор ее собственной соли. Очевидно, что могут проходить два обратимых процесса: растворение (окисление) металла (1) и осаждение (восстановление) металла из раствора на металлическую пластинку (2). Направление преобладающего процесса в равновесной системе зависит от нескольких факторов, к которым относятся:
Для изучения механизма возникновения ЭДС, рассмотрим процессы, которые будут проходить в системе, созданной при погружении какой-либо металлической пластинки в раствор ее собственной соли. Очевидно, что могут проходить два обратимых процесса: растворение (окисление) металла (1) и осаждение (восстановление) металла из раствора на металлическую пластинку (2). Направление преобладающего процесса в равновесной системе зависит от нескольких факторов, к которым относятся:
1. Восстановительные свойства металла, зависящие от его природы.
2. Концентрация (активность) ионов металла в растворе соли, изменение которой влияет на установившееся равновесие, в соответствии с правилом Ле-Шателье. При увеличении концентрации соли в растворе, начинает преобладать процесс восстановления металла из раствора на металлическую пластинку.
Рассмотрим, как влияют восстановительные свойства металла на установившееся равновесие.
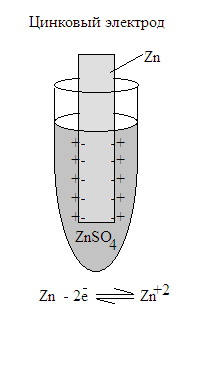
Было доказано: если металл активный (Zn, Fe, Mg и т.д.), то в системе преобладает процесс растворения (окисления) металла, например:
Zn – 2 ē → Zn+2
 Катионы металла переходят в раствор и слой раствора, прилежащий к металлу, приобретает положительный заряд. Поверхность металла, при этом, приобретает некоторый отрицательный заряд, за счет оставшихся на нем электронов. Такая система называется цинковым электродом.
Катионы металла переходят в раствор и слой раствора, прилежащий к металлу, приобретает положительный заряд. Поверхность металла, при этом, приобретает некоторый отрицательный заряд, за счет оставшихся на нем электронов. Такая система называется цинковым электродом.
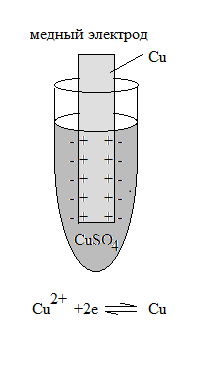
Если создать электрод из неактивного металла, например Cu, Au, Hg и проч., то будет преобладать процесс осаждения металла на металлическую пластинку, т.е. процесс восстановления металла:
Cu +2 + 2 ē → Cu
Поверхность металла зарядится положительно, а прилежащий к нему слой раствора – отрицательно. В обоих случаях, на границе «металл - раствор» (в нашем случае Cu/Cu+2 или Zn/Zn+2) образуется двойной электрический слой, величина которого определяется разностью возникших потенциалов.
Дата добавления: 2016-03-15; просмотров: 985;
