Химическая связь. Комплексные соединения
Учение о химической связи - центральная проблема современной химии. Без знания природы взаимодействия атомов невозможно понять причины разнообразия свойств химических веществ, которых насчитывается уже около 70 млн., представить механизм их образования, их состав, строение и реакционную способность. Взаимодействие атомов, приводящее к образованию двух и многоатомных систем - молекул, ионов, радикалов - обусловлено перекрыванием их электронных орбиталей, что сопровождается объединением атомов в одно целое химическими связями и смешением полной энергии системы (молекул, ионов, радикалов).
Основные положения теории химической связи были сформулированы в конце 20-х - начале 30-х годов ХХ века (В. Гайтлер, Ф.Лондон - метод валентных связей (ВС), Р.Малликен - метод образования молекулярных орбиталей путем линейной комбинации атомных орбиталей (МО ЛКАО). В настоящее время эти две теории химической связи существуют параллельно, дополняя друг друга. В соответствии с методом ВС, химическая связь образуется за счет перекрывания электронных облаков двух атомов с антипараллельными спинами с образованием общей электронной пары (ковалентная связь): А + ¯В ® А¯В . В соответствии с методом МО ЛКАО, связь между двумя атомами осуществляется за счет размещения электронов на общих молекулярных орбиталях (связывающих или разрыхляющих).
Ковалентная связь. Стоит подробно ознакомиться с методом ВС как наиболее простым и наиболее используемым для объяснения строения молекул и свойств веществ, а также с характерными особенностями ковалентной связи: насыщенностью, направленностью, поляризуемостью. В соответствии с методом ВС химическая связь обусловлена перекрыванием s-, p-, d-, f-орбиталей, которые (кроме s-орбитали) имеют направленность, а электронные облака, кроме того, отличаются формой. В зависимости от способа перекрывания и симметрии электронного облака образуются σ- (сигма) -, π (пи) - и δ (дельта) - связи (рис.2).
σ-Связь осуществляется при перекрытии электронных облаков (ss, sp, pp, dd и т.д.) вдоль линии, соединяющей два ядра. Она всегда одинарная.
π-Связь возникает при перекрытии электронных облаков (pp, dd, pd) по обе стороны от облаков, соединяющих ядра атомов.
δ-Связь образуется при перекрытии всех четырёх лепестков d-электронных облаков, размещающихся в параллельных плоскостях.

Рис. 2. Схема перекрывания орбиталей при образовании σ-, π - и δ-связей: а - положительное перекрывание (связывание); б - отрицательное перекрывание (разрыхление); в - индифферентное перекрывание(несвязывающее).
Если у взаимодействующих атомов нет (или не хватает) неспаренных электронов, то образованию химической связи предшествует процесс распаривания электронов (переход атома в возбужденное состояние) с последующим усреднением орбиталей по форме и энергии (гибридизация атомных орбиталей). Например:
4Be 1s22s22p0 + hν → 4Be* 1s22s12p1
В зависимости от типа гибридизации молекулярные орбитали могут иметь разное направление в пространстве: sp-гибридизация - линейное (угол связи α равен 1800); sp2- гибридизация - к вершинам равностороннего треугольника (a = 1200); sp3- гибридизация - к вершинам тетраэдра (α = 109,50); sp3d - гибридизация - к вершинам тригональной пирамиды или тетрагональной пирамиды; sp3d2 - гибридизация к вершинам октаэдра; sp2d - гибридизация - к вершинам квадрата (α = 900). Кроме того, что гибридные орбитали участвуют в образовании σ-связи, они могут нести на себе неподеленные электронные пары, что в целом определяет геометрию молекул.
К характеристикам связи относятся:
- Длина связи - оптимальное расстояние между ядрами атомов (нм или Å; 1 нм = 10-9 м,
1 Å = 10-10 м);
- Энергия связи - количество энергии по модулю, выделившееся при образовании связи, (при образовании связи энергия выделяется, а при разрушении - поглощается) (кДж / моль);
- Полярность связи - определяется наличием на атомах частичного положительного и отрицательного зарядов, приводящие к возникновению дипольного момента: 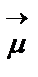 = l×q (Д) (1 Дебай = 3,33∙10-30 Кл∙м), где l-длина диполя, м; q - элементарный заряд, равный 1,602·10-19 Кл. Полярность связи следует отличать от полярности молекулы, которая определяется как сумма векторов дипольных моментов всех связей в молекуле. (Например,
= l×q (Д) (1 Дебай = 3,33∙10-30 Кл∙м), где l-длина диполя, м; q - элементарный заряд, равный 1,602·10-19 Кл. Полярность связи следует отличать от полярности молекулы, которая определяется как сумма векторов дипольных моментов всех связей в молекуле. (Например, 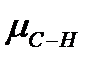 ¹ 0, так как D
¹ 0, так как D 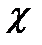 = 3,0-2,2, но
= 3,0-2,2, но 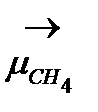 =
= 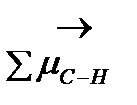 = 0 Д).
= 0 Д).
В зависимости от полярности связи можно охарактеризовать три разных случая:
1. Очевидно, если А = В, на атомах не создаются частичные заряды, это соответствует возникновению между ними ковалентной неполярной связи (общие электроны не смещены ни к одному из атомов).
2. Если А¹В, электроны смещены к более электроотрицательному атома, на последних возникают частичные заряды q <0,5, приводящие к образованию ковалентной полярной связи.
3. Если q> 0,5, то считается, что электроны принадлежат практически полностью одному из атомов; образуется катион и анион, между которыми осуществляется электростатическое притяжение - ионная связь.
Необходимо помнить, что чисто ковалентной и чисто ионной связей не существует. В случае q = 0,5 реализуется примерно 75% ионного типа связи.
Донорно-акцепторная связь. Комплексные соединения. Необходимо особое внимание уделить донорно-акцепторному механизму образования ковалентной связи, суть которого заключается в поставке готовой пары электронов (неразделенной пары) одним атомом (донором) на вакантную орбиталь другого атома (акцептора) и образовании общей электронной пары: D¯ + •A ® D¯A. Благодаря донорно-акцепторному взаимодействию удается стабилизировать отрицательную степень окисления металлов:
Na3[ 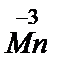 (NO)3CO], Na[
(NO)3CO], Na[ 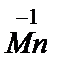 (CO)5], Na[
(CO)5], Na[ 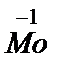 (СО)6].
(СО)6].
Соединения, в которых реализуется донорно-акцепторный механизм ковалентной связи, называются комплексными или координационными соединениями («соединения в квадратных скобках»). В становлении координационной химии выделяют три этапа: первый связан с публикацией в 1893 г. А.Вернера основных положений теории координационных соединений; второй (примерно от середины ХХ в.) - с синтезом и выявлением строения комплексов металлов с различными органическими соединениями; третий (последние два десятилетия) – связан с исследованиями комплексообразования на поверхности на наноуровне («нанотехнология») и синтезом супрамолекулярных соединений («супрамолекулярная координационная химия»). Полезно ознакомиться с современным состоянием химии комплексных соединений и ее значением для техники и промышленности в учебном пособии: В.В.Скопенко, А.Ю.Цивадзе, Л.И.Савранский, А.Д.Гарновский «Координационная химия» - М .: ИКЦ «Академкнига», 2007 - 487с.
В учебниках для инженерных специальностей эта тема рассматривается в основном на уровне первого (вернеровского) этапа. Следует обратить внимание на следующее.
1. В большинстве координационных соединений различают внутреннюю и внешнюю сферы, имеющие противоположные заряды. Например, в комплексах цинка: а) Na2[Zn(OH)4] и б) [Zn(NH3)4]Cl2 внутренними сферами являются Zn(OH)4]2- и [Zn(NH3)4]2+, а внешними - ионы Na+ и Cl- соответственно. Ион Zn2+ (акцептор) для образования комплексных ионов поставляет одну 4s- и три 4 р-орбитали. Ионы ОН- и молекулы NH3 называются лигандами (доноры электронных пар). В каждом комплексе вокруг ц.а. координированны по 4 лиганда, т.е. координационное число иона Zn2+ равно четырем.
Внутренняя сфера не всегда имеет заряд. Например, в разнолигандном комплексе [Pt(NH3)2Cl4] заряд отсутствует (равен нулю).
2. Атомные орбитали центрального атома гибридизуются (например, в Zn2+ sp3-гибридизация), что приводит к укреплению донорно-акцепторной связи, а для комплексов с одинаковыми лигандами - к образованию симметричных структур (тетраэдров, октаэдров и т.д.). При растворении в воде комплексы легко диссоциируют на внутреннюю и внешнюю сферу (ионный характер связи). Это первичная диссоциация, она происходит по типу диссоциации сильных электролитов. Комплексные ионы также диссоциируют на ион-комплексообразователь и лиганды. Например, [Zn(OH)4]2- ↔ Zn2+ + 4OH-. Но это вторичная, незначительная диссоциация, равновесие смещено влево. Константа этого равновесия называется константой нестойкости (Кн). Для иона [Zn(OH)4]2- Кн имеет выражение и значение:
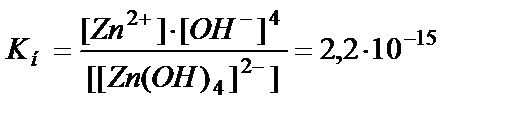
Константа нестойкости является мерой устойчивости комплексов: чем меньше константа, тем более устойчиво комплексное соединение. С этой точки зрения двойные соли, например, (NH4)2Fe(SO4)2, KMgCl3 и другие не являются комплексами, потому что диссоциируют в водном растворе в одну стадию, как сильные электролиты.
При составлении уравнений обмена с участием комплексных соединений имейте в виду, что комплексные ионы, как правило, не разрушаются, а переходят целиком из одного соединения в другое. Например:
2K3[Fe(CN)6]+3CuSO4®Cu3[Fe(CN)6]2¯+3K2SO4;
2[Fe(CN)6]3-+3Cu2+®Cu3[Fe(CN)6]2¯.
Для объяснения магнитных, спектральных и ряда других свойств комплексных соединений в настоящее время используется теория кристаллического поля, с основными положениями которой можно ознакомиться по учебнику и задачнику Н.Л. Глинки.
Задача 1. Составить формулу комплексного соединения, если комплексообразователем является ион Со3+, лигандами - молекулы NH3, а внешняя сфера образована ионами Сl-.
Решение. Если степень окисления комплексообразователя 3+, координационное число, как правило (но не всегда!), будет равняться 6, то есть во внутренней сфере должно быть 6 молекул NH3. Поэтому комплексный ион имеет вид [Co(NH3)6].
По алгебраической сумме зарядов всех частиц, входящих в комплексный ион, вычислим заряд комплексного иона. Молекулы NH3 не имеют заряда, то есть, алгебраическая сумма: 3 + 6·0 = 3+, следовательно, формула комплексного иона - [Co(NH3)6]3+. Чтобы молекула комплексного соединения была нейтральной, во внешней сфере должно быть три ионы Сl-. Таким образом, формула комплексного соединения: [Co(NH3)6]Cl3 .
Задача 2. Написать уравнения диссоциации ионов [Ag(NН3)2]+ и [Ag(CN)2]-, а также выражение для констант нестойкости. Сравнить численные значения констант нестойкости и указать, какой из приведенных ионов более устойчив.
Решение.
[Ag(NH3)2]+ « Ag+ + 2NH3 Кн = 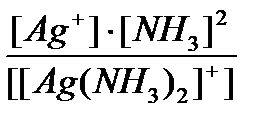 = 6,8×10-8
= 6,8×10-8
[Ag(CN)2]- « Ag+ + 2СN- Kн = 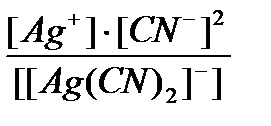 = 1×10-21.
= 1×10-21.
Константа нестойкости второго иона значительно меньше, следовательно, комплексный ион [Ag(CN)2]- более устойчив в растворе.
Задача 3. Напишите в молекулярной и ионной форме уравнение реакции обмена, учитывая, что образуется нерастворимое комплексное соединение:
Решение.
2Na3[Co(CN)6] + 3FeCl2 ® Fe3[Co(CN)6]2¯ + 6NaCl;
2[Co(CN)6]3- + 3Fe2+ ® Fe3[Co(CN)6]2¯.
Дата добавления: 2016-02-27; просмотров: 3112;
