Строение атома. Периодический закон. Свойства элементов
При изучении данной темы следует обратить внимание на ряд понятий и положений, которые требуют абстрактного восприятия. К концу XIX в. в химии господствовало представление о неделимости атома (атомос - с греческого, неделимый). Но опыты Крукса и Перрена (1880-1885 гг.) по катодным лучам, определение природы явления термо- и фотоэлектронной эмиссии, и особенно открытие самопроизвольного (спонтанного) радиоактивного распада ядер тяжелых элементов А.Беккерелем (1896 г.), наглядно свидетельствовали о сложной природе атомов. В этот же период были открыты и охарактеризованы две меньшие, чем атом, элементарные частицы - электрон (в 1891 г. Дж.Стоней предложил термин "электрон") и протон (Дж. Томсон и В.Вин - 1896 г.). Третья элементарная частица - нейтрон, была открыта Дж. Чедвиком (1932 г.) при изучении ядерных реакций.
Масса электрона равна 9,1094·10-31 кг, что составляет примерно 1/1840 массы атома водорода; размер электрона 10-15 м. Заряд электрона (Р. Малликен, 1909 г.) равен 1,6021·10-19 Кл; его величину принято за единицу заряда (то есть, -1). Масса покоя протона 1,6725·10-27 кг (или 1,00727 а.е.м.), заряд протона положительный и имеет значение +1. Нейтрон - стабильная элементарная часть с массой покоя 1,6747·10-27 кг (или 1,008665 а. е.м.), без электрического заряда. Стоит отметить, что на сегодняшний день открыто более 100 элементарных частиц. Наименьшими частицами являются кварки, носители частичных зарядов (u - кварки имеют заряд + ⅔, а d-кварки имеют заряд - ⅓). Считается, что протон состоит из трех кварков в сочетании uud, а нейтрон - результат комбинации udd. Предполагается, что кварки состоят из еще меньших частиц - прокварков (Преоне, Ришон).
Формирование современной теории строения атома происходило поэтапно. В 1911 г. Э.Резерфорд экспериментально доказал наличие ядер у атомов и предложил планетарную (ядерную) модель атома, а затем в 1913 г. датским физиком Н. Бором была разработана теория строения атома водорода, которая исходила из модели Э. Резерфорда и учения А.Ейнштейна (1905 г.). Положения теории Н. Бора рассмотрены во всех учебниках. Отметим лишь, что теория Н.Бора, несмотря на недостатки, позволила теоретически вычислить скорость движения электрона на стационарных круговых орбитах, энергию орбит и их радиусы. Радиусы стационарных орбит, по Н.Бору, можно вычислить по формуле: rn = 0,529·10-10 n² м. Величина 0,529Å (1Å = 1 Ангстрем = 10-10 м), или 0,0529 нм (1 нм = 1 нанометр = 10-9 м ) является наименьшей (n = 1) и называется Боровским радиусом.
Скорость движения электрона на круговых орбитах, по Н.Бору, равна υn = 2,167· 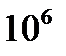 ·
·  м/c, а энергия Еn = -13,6 ·
м/c, а энергия Еn = -13,6 ·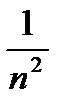 эВ. Во всех формулах присутствует величина n, названная главным квантовым числом, она принимает значения от 1 до бесконечности.
эВ. Во всех формулах присутствует величина n, названная главным квантовым числом, она принимает значения от 1 до бесконечности.
В 1924 г. французский физик Луи де Бройль предположил двойственную корпускулярно-волновую природу любых движущихся материальных частиц и вывел уравнение волновой механики:
λ = h / (mυ),
где λ - длина волны, m - масса частицы, υ - скорость ее движения, h - постоянная М.Планка. Итак, любая элементарная частица, безусловно, материальная (то есть, является корпускулой с определенной массой покоя), но ее движение имеет волновую природу.
В 1925 г. В.Гейзенберг сформулировал принцип неопределенности: в масштабах атомов невозможно с математической точностью выявить траекторию движения микрочастицы, а следовательно ее скорость, точное местонахождение (ее координаты) и ее количество движения (импульс р = mυ). Можно говорить лишь о вероятности нахождения элементарных микрочастиц в определенных точках пространства (в частности пребывания электрона в атомном пространстве). Как модель состояния электрона в атоме, в квантовой механике было принято представление об электронном облаке (а не Боровской круговой орбите), часть соответствующих участков которого пропорциональна вероятности нахождения там электрона. Чаще электронное облако изображают в виде предельной поверхности, которая охватывает 90% заряда и массы.
В 1927 г. Е Шредингер предложил волновое уравнение - основное уравнение квантовой механики:
ĤΨn = EnΨ,
в котором квадрат волновой функции (| Ψ |²) ("пси" квадрат) характеризует вероятность (точнее, плотность вероятности) обнаружения электрона на определенных расстояниях от ядра. Волновое уравнение Шредингера является дифференциальным уравнением второго порядка в частных производных. У него три неизвестных - Ψ, E, V. Найти их можно при совместном решении его с двумя другими уравнениями:
а) для потенциальной энергии,
б) для граничных условий: Ψ = 0, если r → ∞.
Следствием решения уравнения Е.Шредингера для атома водорода есть 3 квантовых числа (n, l, ml), характеризующие атомную орбиталь. Орбиталь - область пространства, в которой вероятность нахождения электрона составляет 90%. В качестве модели состояние электрона в атоме принято изображать в виде электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения там электрона. Возможные формы электронных облаков в атоме показаны на рисунке (рис. 2). Обратите внимание, что орбиталь описывается волновой функцией, которая может иметь как положительное, так и отрицательное значение. При переходе от атома водорода к многоэлектронным атомам формы s-, p-, d-, f-орбитали качественно остаются теми же, их считают примерно такими же, как в возбужденном атоме водорода. Но для точных квантово-химических расчетов пользуются методом последовательных приближений, который подробно рассматривается в спецкурсе квантовой химии.
В квантово-механических моделях атома энергетическое состояние электрона описывается набором из четырех квантовых чисел.
1. Главное квантовое число n - мера энергии электрона в атоме, размер электронного облака. Принимает значение: n = 1,2,3,4 ... ...∞
2. Орбитальная квантовое число l - момент количества движения электрона на орбитали, форма электронного облака. Принимает значение l = 0,1,2,3, ... (n-1). Численным значением ставятся в соответствие буквы: s, p, d, f - латинского алфавита.
3. Магнитное квантовое число ml - определяет ориентацию электронного облака в магнитном поле ядра на данном энергетическом подуровне. Принимает значение: ml = -l, (l-l), ... 0 ... (l+1), l. Для каждого l максимально возможные (2l + 1) значений ml, а для каждого n максимально возможные n2 значений ml: s-орбиталь имеет одну ориентацию в пространстве (ml = 0), p-орбитали - три (ml = -1, 0, 1), расположенные вдоль осей х, y, z в декартовой системе координат (px, py, pz), d-орбитали - пять (ml = -2, -1, 0, 1, 2), расположенные вдоль биссектрис в декартовых плоскостях (dxy, dyz, dzx) и на осях в тех же плоскостях (d 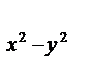 , d
, d  ).
).
4. Спиновое квантовое число ms - момент собственного количества движения электрона; может принимать значения +1/2 и -1/2. Это квантовое число не связано с другими тремя, то есть не является следствием решения уравнения Шредингера. Условно спин электрона принято обозначать стрелкой ↑ или ↓.
Электроны с одинаковым значением главного квантового числа n образуют квантовый слой близких по размерам облаков. Квантовые уровни построены из подуровней, сочетающие электроны с одинаковым значением орбитального квантового числа l. Подуровни составленные из орбиталей: на каждой орбитали могут находиться максимум два электрона (с противоположными спинами). Максимальная электронная емкость уровня равна 2n2, а подуровня 2(2l + 1).
Если дано три квантовых числа n, l, ml, то тем самым определено и волновую функцию электрона - атомную орбиталь иногда изображают как энергетическую ячейку ("квантовую ячейку") в виде квадрата.
Для s - электронов может быть только одна орбиталь или одна энергетическая ячейка.
Для р - электронов - три .
Для d - электронов - пять .
Для f - электронов - семь .
При заполнении орбиталей электронами в сложных атомах следует учитывать три правила:
1.Правило минимальных энергий: электроны заполняют орбитали по мере роста энергии последних. Величину энергии определяют по двум правилам Клечковского: с увеличением заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n = l) к орбиталям с большим значением этой суммы (первое правило). При одинаковых значений суммы (n = l) заполнения орбиталей происходит последовательно в направлении роста главного квантового числа n (второе правило).
2. Принцип запрета Паули: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Это положение наглядно можно проиллюстрировать на примере элемента 2Не: первый электрон характеризуется квантовыми числами n = 1, l = 0, ml = 0, ms = +1/2; для второго электрона три первые квантовые числа совпадают, но четвертое (спиновое) имеет значение 1/2, то есть отличается по знаку.
3. Правило Хунда: электронная система невозбужденного атома в пределы подуровня стремится к максимуму суммарного спина, то есть, в пределах подуровня сумма спиновых чисел должна быть максимальная. Например, для элемента 6С на 2р-подуровне суммарный спин будет максимальным только в случае: 6С ↑ ↑ ↑.
Существуют два условных способы изображения заселенности электронных оболочек атомов: в виде электронных формул и в форме квантовых ячеек.
Например:
1) 11Na 1s²2s²2р63s¹ или [Ne] 3s¹.
2) 11Na ↑.
Необходимо обратить внимание на то, что периодическая система элементов построена в соответствии с периодическим законом Д.И. Менделеева, современная формулировка которого: физические и химические свойства элементов и их соединений находятся в периодической зависимости от зарядов их ядер.
Химическая природа элемента зависит от способности его атомов терять или приобретать электроны. Эта способность количественно оценивается энергией ионизации атома и сродством к электрону.
Потенциал ионизации (I) - энергия, необходимая для отрыва электрона с орбитали и удаление его на бесконечное расстояние от ядра. В периодах от s-элементов 1 группы в p-элементов VIII группы энергия ионизации увеличивается, что обусловлено ростом заряда ядра и количества внешних электронов. (Сила взаимодействия между ними растет по закону Кулона: F = q1q2 / r2). С началом нового периода энергия ионизации снова снижается. Таким образом, в пределах периода это свойство изменяется почти монотонно, а от периода к периоду - скачкообразно. В соответствии с этим, химические свойства в периоде монотонно изменяются от типичного металла к неметаллу, а затем скачком - от инертного газа к щелочному металлу.
Сродство к электрону (E) - количество энергии, выделяющееся при присоединении электрона к нейтральному атому. В периодах слева направо Е увеличивается. Как и потенциал ионизации, сродство к электрону от периода к периоду меняется скачкообразно.
Полусумма I и Е обозначается как электроотрицательность (ЭО) (Л. Полинг, 1931 г.). Таблица значений относительной электроотрицательности (χ - греч. "каппа") приведена в задачнике М.Л.Глинки, а также в приложении.
Периодический закон и периодическая система элементов Д.И. Менделеева являются основой изучения химии элементов. Руководствуясь этим, в общей характеристике элементов необходимо уметь определять следующее:
- Положение элемента в периодической системе, электронную структуру атома, возможные степени окисления;
- Закономерности в изменениях радиусов атомов, энергии ионизации, электроотрицательности в периоде и подгруппе;
- Наиболее характерные свойства простых веществ, образованных элементами, закономерности в изменении свойств по периодам и подгруппам;
- Формы соединения элементов с водородом, кислородом, некоторыми другими элементами;
- Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств оксидов, гидроксидов по периодам и подгруппам.
Задача 1. Напишите электронную формулу (расположение электронов на уровнях и подуровнях) ионов Na+ и Cl-.
Решение. Элементы 11Na и 17Сl имеют электронные формулы: 1s22s22p63s1 и 1s22s22p63s23p5 соответственно. При образовании ионов Na + и Сl- натрий отдает один электрон, а хлор, наоборот, присоединяет электрон. Итак, электронные формулы имеют вид:
Ион Na+: 1s22s22p63s0 ;
ион Cl- : 1s22s22p63s23p6 .
Задача 2. Расположите 4p, 3d, 4s, 4d-орбитали в порядке возрастания энергии.
Воспользуемся правилами Клечковского и найдем сумму n + l для каждой из орбиталей:
4s (4 + 0 = 4); 3d (3 + 2 = 5); 4р (4 + 1 = 5); 4d (4 + 2 = 6). Тогда ряд имеет следующий вид: 4s, 3d, 4p, 4d.
Задача 3. На основе распределения электронов на уровнях и подуровнях атомов 15Р и 23V укажите: а) металл или неметалл; б) возможные степени окисления; в) формулы оксидов и их гидратов, а также возможные соединения с водородом этих элементов.
Решение. Элемент 15Р (фосфор) имеет электронную конфигурацию: 1s22s22p63s23p3. Это - неметалл, валентными электронами является 3s23р3, то есть, фосфор способен принимать при химических превращениях три электрона и отдавать пять, образуя соединения, в которых он проявляет степень окисления от -3 до +5. Но наиболее распространенными являются степени окисления: -3 (РН3), 0 (элементарный Р), +3 (Р2О3, Н3РО3), +5 (Р2О5, Н3РО4). Электронная формула элемента 23V (ванадий): 1s22s22p63s23p63d34s2; это d-элемент, металл. Валентными электронами является 3d34s2. Ванадий образует соединения, в которых он проявляет степени окисления от 0 (элементарный ванадий) до +5:
+2 : VO, V(OH)2 ;
+3 : V2O3, V(OH)3 ;
+4 : VO2 , V(OH)4, H2VO3 ;
+5 : V2O5 , H3VO4, HVO3 .
Задача 4. Запишите электронную конфигурацию и энергетическую диаграмму элементов с порядковыми номерами: 23 и 33.
Решение. Используем правила заполнения:
1s22s22p63s23p63d34s2; 1s22s22p63s23p63d34s23d104s24p3.
Энергетическая диаграмма (графическая формула) имеет вид:
Z = 23 (23V ) Z = 33 (33As)
3d 4p
4s ¯ 4s ¯
3p ¯ ¯ ¯ 3d ¯ ¯ ¯ ¯ ¯
3s ¯ 3p ¯ ¯ ¯
2p ¯ ¯ ¯ 3s ¯
2s ¯ 2p ¯ ¯ ¯
1s ¯ 2s ¯
1s ¯
Дата добавления: 2016-02-27; просмотров: 1066;
