Рекомендации к изучению теоретического материала
Закон эквивалентов - экспериментально установленный немецким химиком В.Рихтером (1797 р.) и сформулирован Дж. Дальтоном (1803 г.): химические элементы и вещества взаимодействуют между собой и образуют новые вещества в количествах, пропорциональных их эквивалентам. Математическое выражение закона эквивалентов: m1 / m2 = Э1 / Э2.
Эквивалент веществ - или элемента - это реальная или условная частица вещества, которая взаимодействует с 1 моль атомов или ионов водорода или ½ моль атомов кислорода. Например, в НВr эквивалент брома составляет 1 моль, так как с 1 моль атомов водорода соединяется 1 моль атомов Вr. Эквивалент кислорода в Н2О равна ½ моль, а азота в NH3 - 1/3 моль. Числа 1, ½ и 1/3 называются фактором эквивалентности (f).
Молярная масса эквивалента - масса 1 эквивалента, выраженная в граммах (me). Она равна произведению фактора эквивалентности и молярной массы вещества: mэ = f·Mr. Эквивалентная масса водорода равна 1 г, его эквивалентный объем (Vэ(H)) составляет 11,2 л. Для кислорода равны соответственно 8 г / моль (масса эквивалента) и 5,6 л / моль (эквивалентный объем, Vэ(О)).
Таким образом, закон эквивалентов можно сформулировать так: массы веществ, участвующих и образующихся в реакции, относятся между собой как их молярные массы эквивалентов: m1 / m2 = mэ(1) / mэ(2). Если в рекции участвуют газообразные вещества, расчеты выполняют по формуле: m / V = mэ / Vэ.
Чтобы свободно оперировать законом эквивалентов, необходимо научиться рассчитывать молярные массы эквивалентов элементов в соединениях и молярные массы эквивалентов сложных веществ.
Молярная масса эквивалента элемента в соединении численно равна отношению его молярной массы к степени окисления (валентности) этого элемента в соединении:
mэ = М / В.
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих:
- Для оксида: mэ оксида = mэ элемента + 8 или отношению молярной массы оксида к удвоенному количеству атомов кислорода: mэ оксида = Моксида / 2n;
- Для кислоты: mэ кислоты = mэ кисл. остатка + 1 или отношению молярной массы кислоты к ее основности: mэ кислоты = Мкислоты / основность. Необходимо учитывать, что основность кислоты определяется по конкретной реакции. Например:
Н2SO4 + NaOH → NaHSO4 + H2O - основность кислоты в данной реакции равна 1.
Н2SO4 + 2NaOH → Na2SO4 + 2H2O - основность кислоты в данной реакции равна 2;
- Для основания: mэ основания = mэ металла + 17 или отношению молярной массы основания к его кислотности: mэ основания = Моснования / кислотность. Кислотность основания определяется по уравнению реакции. Например:
Cr(OH)3 + HCl → Cr(OH)2Cl + H2O - кислотность гидроксида хрома в данной реакции равна 1;
- Для соли - mэ соли = mэ катиона + mэ аниона или отношению молярной массы соли к произведению количества иона (катиона или аниона) на его заряд по модулю: mэ соли = Мсоли / n·z, где n - число катионов (или анионов) ; z - заряд иона (по модулю).
Задача 1. Вычислите эквивалентную массу металла и его оксида, если в 0,42 г оксида содержится 0,30 г этого металла.
Решение. Находим массу кислорода, содержащегося в оксиде: m 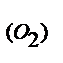 = m
= m 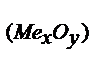 – m
– m 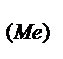 = 0,42 - 0,30 = 0,12 (г). Определяем эквивалентную массу металла по закону эквивалентов:
= 0,42 - 0,30 = 0,12 (г). Определяем эквивалентную массу металла по закону эквивалентов:
m(Me) / m(O2) = mэ(Me) / mэ(O), откуда mэ(Me) = (m(Me)·mэ(O) ) / m(O2) = 0,30·8:0,12 = 20 г/моль.
Эквивалентную массу оксида металла рассчитываем по формуле:
mэ оксида = mэ металла + 8 = 20 + 8 = 28 (г/моль).
Задача 2. Определить эквивалентные массы металла и его оксида, если 4,61 г этого металла вытесняет из кислоты 0,375 г водорода (н.у.).
Решение. Согласно закону эквивалентов, mэ(Me) = (m(Me)·mэ(H) ) / m(H2)
mэ(Me) = 4,61×1:0,375 = 12,29 (г/моль). m 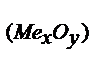 = mэ(Me) + 8 = 12,29 + 8 = 20,29 (г/моль).
= mэ(Me) + 8 = 12,29 + 8 = 20,29 (г/моль).
Задача 3. Определите эквивалентную массу металла, если на образование 2,72 г его оксида нужно 0,328 л О2, находящегося при температуре 270оС и давлении 303,9 кПа.
Решение. Сначала найдем массу кислорода, используя уравнение Клапейрона-Менделеева: 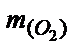 =
= 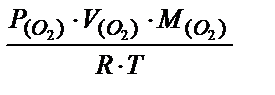 = (303,9×0,328×32):(8,31×300) = 1,28 (г).
= (303,9×0,328×32):(8,31×300) = 1,28 (г).
Далее определяем массу металла = 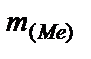 =
= 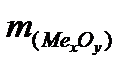 -
- 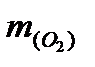 = 2,72 - 1,28 = 1,44 (г).
= 2,72 - 1,28 = 1,44 (г).
Эквивалентные массы металла и оксида рассчитаем как и в предыдущем примере: mэ(Me) = (m(Me)·mэ(O) ) / m(O2) = 1,44 × 8:1,28 = 9 (г/моль);
m 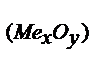 = mэ(Me) + 8 = 9 + 8 = 17 (г/моль).
= mэ(Me) + 8 = 9 + 8 = 17 (г/моль).
Задача 4. Вычислить эквивалентную массу хлора в его оксиде, который содержит
61,2% кислорода. Какую формулу имеет оксид?
Решение. Найдем содержание хлора в оксиде 100 - 61,2 = 38,8 (%). Пользуясь законом эквивалентов, запишем:
m(Cl) / m(O2) = m э(Cl) / mэ(O), или: mэ(Cl) = m(Cl)·8 / m(O2) = (38,8·8)/61,2 = 5,07 г/моль-экв.
Масса эквивалента хлора равна отношению молярной (атомной) массы хлора к его валентности: mэ (Cl) = Ar (Cl) / B.
Итак: В = Ar (Cl): mэ(Cl) = 35,45: 5,07 = 7. Формула оксида Сl2O7.
Дата добавления: 2016-02-27; просмотров: 1139;
