Энергетика химических процессов
Термодинамика - общая наука об условиях протекания процессов, сопровождающихся изменением энергии в форме теплообмена и выполнением работы различного вида. Химическая термодинамика устанавливает основные закономерности энергетики химических превращений, химического равновесия, фазовых переходов, процессов на границе раздела фаз.
Суть любой реакции заключается в разрыве химических связей исходных веществ (затрата энергии, эндоэффект) и образовании новых (выделение энергии, экзоэффект). Величины этих эффектов никогда не совпадают по модулю, следовательно, каждая реакция сопровождается энергетическим (чаще всего, тепловым) эффектом. Тепловые эффекты рассматривает раздел химии, который называется термохимией. Термохимия является составной частью химической термодинамики, поэтому стоит обратить внимание на некоторые основные понятия термодинамики.
Совокупность тел, выделенных из пространства, образует систему. Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами: основными - температура Т, давление - Р, объем - V, масса - m, количество вещества - n (количество молей) - и дополнительными - количество теплоты и количество работы - А. Для термодинамического описания системы пользуются так называемыми функциями состояния. Функции состояния - это величины, которые зависят от состояния и не зависят от пути, по которому система пришла в данное состояние. Функции состояния: внутренняя энергия U, энтальпия Н, энтропия - S, энергия Гиббса - G, энергия Гельмгольца F - зависят только от начального и конечного состояний системы. Для успешного освоения основ химической термодинамики следует внимательно рассмотреть первое начало термодинамики (Джоуль, 1847 г.), его математическое выражение, и выводы из него:
Q = ΔU + A = ΔU + pΔV
При изохорном течении химического процесса (то есть, ΔV = 0) Q = ΔU, а при изобарном (Δp = 0): Q = (U + pV2) - (U + pV1) = H2 - H1 = ΔH. Соотношение H = U + pV называется энтальпией, или теплоемкостью системы. В термохимии изменение энтальпии (ΔН) называют теплотой.
Основной закон термохимии был сформулирован Г.И.Гессом (1840 гг.): Тепловой эффект химической реакции не зависит от пути процесса, то есть от числа и характера промежуточных стадий, а зависит только от вида (природы) и состояния исходных веществ и конечных продуктов. Иначе говоря, тепловой эффект реакции равен алгебраической сумме тепловых эффектов промежуточных стадий процесса:
ΔНх.р. = ΣΔНi .
Закон Г.И.Гесса имеет несколько следствий, но чаще всего используют такой: тепловой эффект реакции равен сумме теплот образования (ΔНf) продуктов реакции за вычетом суммы теплот образования (ΔНf) исходных веществ:
ΔН0х.р. = ΣΔНºпрод - ΣΔНºисх .
Индекс f - первая буква слова formation (образование, англ.). Стандартные энтальпии образования (ΔH0обр. или ΔHf,298) являются табличными величинами.
Первое начало (первый закон) термодинамики позволяет рассчитать тепловой эффект химического процесса (ниже приведены примеры таких расчетов), но не указывает на возможность осуществления этого процесса. На возможность осуществления химической реакции указывает второе начало термодинамики. Устойчивость любой системы, в том числе химической, определяется соотношением двух факторов, или двух тенденций. С одной стороны, любая система стремится к упорядочению, агрегации частиц, то есть их объединению и, как следствие, к уменьшению запаса внутренней энергии системы, а с другой - система стремится к измельчению, росту неупорядоченности, потому такое состояние термодинамически более вероятно. Степенью неупорядоченности состояния системы является энтропия (S):
S = k · lnW,
где k = R / NA = 1,38 · 10-23 Дж / К - постоянная Больцмана, равная отношению универсальной газовой постоянной R к числу Авогадро NA, W - вероятность состояния. Энтропия имеет размерность Дж/моль·К. Это очень важная термодинамическая функция, позволяющая предсказать самопроизвольное осуществление химического процесса, т.е. процесса, возможного без действия внешних сил. Согласно второму началу термодинамики, в изолированной системе самопроизвольные процессы протекают в направлении возрастания энтропии. Если в результате процесса ΔS> 0, то процесс термодинамически возможен, а если ΔS <0, то его самопроизвольное течение невозможно. Энтропия реакции ΔS определяется соотношением, аналогичным выражения для энтальпии реакции ΔН:
ΔS0х.р. = ΣSºпрод - ΣSºисх .
Произведение ТΔS (Дж / моль или кДж / моль) называют энтропийным фактором. Для выявления возможности самопроизвольного протекания химического процесса целесообразно ввести такую новую функцию состояния, которая учла бы общее влияние двух указанных выше факторов (тенденций) - энтальпийного (ΔН) и энтропийного (ТΔS). Дж.У.Гиббс (1895 г.) ввел функцию G, которая называется изобарно-изотермическим потенциалом (свободная энергия Гиббса). При постоянном давлении ΔG = ΔН - ТΔS. Химический процесс возможен только в том случае, если свободная энергия Гиббса при этом уменьшается (ΔG <0). Увеличение энергии Гиббса (ΔG> 0) свидетельствует о том, что при данных условиях процесс невозможен. Если ΔG = 0, то система находится в состоянии химического равновесия. Как и изменение энтальпии и энтропии системы, изменение энергии Гиббса может быть рассчитано по формуле:
ΔG0х.р. = ΔG0f, прод. - ΔG0f, исх.
Температуру начала реакции легко найти из соотношения:
ΔН - ТΔ S <0 (реакция возможна). Откуда: T> (ΔН / ΔS)
При условии постоянства объема (для изохорных процессов) состояние системы может быть описано аналогично энергии Гиббса функцией F, которая называется изохорно - изотермическим потенциалом или свободной энергией Гельмгольца:
Δ F = Δ U - ТΔ S.
Соотношение между ΔG и ΔF такое же, как между ΔН и ΔU, то есть они отличаются на величину работы расширения:
ΔG - ΔF = pΔV = ΔnRT.
Задача 1. Определить энтальпию для реакции сгорания метана СН4.
Решение. Запишем уравнение реакции: СН4 + 2О2 = СО2 + 2Н2О.
По закону Гесса: DН0х.р. = (DН0СО2 + 2DН0Н 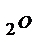 ) – (DН0СН
) – (DН0СН 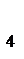 + 2DН0О
+ 2DН0О 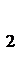 ). Из таблиц находим DН0СО
). Из таблиц находим DН0СО 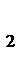 = -393,5 кДж/моль; DН0СН
= -393,5 кДж/моль; DН0СН 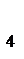 = 74,8 кДж/моль; DН0Н
= 74,8 кДж/моль; DН0Н 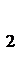 О = -241,8 кДж/моль. Поскольку ΔН0О2 = 0, рассчитываем DН0х.р. = -802,3 кДж.
О = -241,8 кДж/моль. Поскольку ΔН0О2 = 0, рассчитываем DН0х.р. = -802,3 кДж.
Задача 2. Сколько теплоты выделится при сгорании 44,8 л ацетилена С2Н2?
Решение: Определяем, сколько теплоты выделяется при сгорании 1 моль (22,4 л) ацетилена:
С2Н2 + 5/2 О2 = 2 СО2 + Н2О (г); ΔНх.р. - ?
Согласно следствию из закона Гесса, тепловой эффект реакции сгорания ацетилена (ΔНх.р.) равен:
ΔНх.р. = (2ΔНообр.СО2 + ΔНообр.Н2О) – (ΔНообр.С2Н5 + 5/2 ΔНообр.О2) = 2(-393,5) + (-241,8) – 226,8 – 5/2 (0) = -1255,6 кДж/моль. По условию задачи, в реакцию вступило 44,8: 22,4 = 2 моля С2Н2. Таким образом, при сгорании 2 моль ацетилена выделится 1255,6·2 = 2511,2 кДж теплоты.
Задача 3. Определить температуру, при которой начинается прямая реакция:
С (гр) + Н2О (пар) = СО (г) + Н2 (г).
Решение: Температуру начала реакции рассчитаем по формуле:
Т = 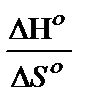 .
.
DН0х.р.= (DН0обр(СО) + DН0обр (Н 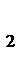 )) - (DН0обр(С) + DН0обр.(Н
)) - (DН0обр(С) + DН0обр.(Н 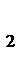 О)) = -110,5 + 241,8 = 131,3 кДж/моль.
О)) = -110,5 + 241,8 = 131,3 кДж/моль.
DS0х.р. = (S0(СО) + S0(Н 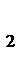 )) - (S0(С) + S0(Н
)) - (S0(С) + S0(Н 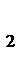 О)) = 197,5 + 130,5 - 5,7 - 188,7 = 133,6 Дж/моль×К @ 0,134 кДж/моль×К.
О)) = 197,5 + 130,5 - 5,7 - 188,7 = 133,6 Дж/моль×К @ 0,134 кДж/моль×К.
Тогда: Т = 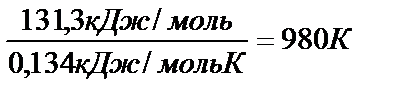 (7070С).
(7070С).
Итак, при температуре выше 980 К становится возможным прямой процесс.
Дата добавления: 2016-02-27; просмотров: 1241;
