Лекция 22. ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Нейродегенеративные заболевания характеризуются прогрессирующим и необратимым повреждением нейронов в различных отделах ЦНС. При болезни Паркинсона и хорее Гентингтона уменьшается количество дофаминергических синапсов в базальных ганглиях, что нарушает контроль произвольных движений. При болезни Альцгеймера атрофируются нейроны коры больших полушарий и гиппокампа с потерей интеллекта, памяти и навыков практической деятельности. У больных боковым амиотрофическим склерозом (БАС) слабость скелетных мышц вызвана дегенерацией мотонейронов спинного мозга и ствола головного мозга, а также пирамидных клеток коры больших полушарий. Характер повреждения зависит от чувствительности нейронов к действию возбуждающих нейромедиаторов, особенностей биоэнергетики и интенсивности свободнорадикальных реакций окисления. Нейродегенеративные заболевания обычно развиваются у людей пожилого возраста, создавая серьезные медицинские и социальные проблемы.
Болезни Паркинсона, Альцгеймера и БАС появляются в популяции спорадически, хотя известны и семейные случаи. При этих заболеваниях наследуется предрасположенность к повреждению нейронов под влиянием неблагоприятных воздействий внешней среды. Хорея Гентингтона - генетическое заболевание с аутосомно-доминантным типом наследования.
При болезни Паркинсона этиологическое значение имеют нейроинфекции и интоксикации. Известно, что эпидемия летаргического энцефалита в конце 1910-х гг. сопровождалась увеличением заболеваемости болезнью Паркинсона, однако в настоящее время такая связь не прослеживается. В 1980 г. была описана форма паркинсонизма у людей, которые синтезировали и употребляли наркотик типа меперидина, загрязненный одним из побочных продуктов синтеза - N-метил-4-фенил-1,2,3,6-тетрагидропиридином.
В пожилом возрасте ухудшается кровоснабжение мозга, накапливаются мутации в геноме митохондрий. Эти нарушения ухудшают аэробный метаболизм нейронов. При нейродегенеративных заболеваниях дефекты биоэнергетики выражены намного больше, чем у пожилых людей без патологии ЦНС. Так, при болезни Паркинсона нарушается функция дыхательной цепи митохондрий в дофаминергических нейронах. N-метил-4-фенил-1,2,3,6-тетрагидропиридин подавляет энергопродукцию в дофаминергических нейронах черной субстанции среднего мозга.
Нейроны обладают высокой чувствительностью к патогенному влиянию гидроперекисей и свободных радикалов кислорода. Эти вещества повреждают ДНК и инициируют перекисное окисление мембранных липидов. В условиях окислительного стресса нервную ткань защищают эндогенные антиоксиданты: аскорбат, восстановленный глутатион и супероксиддисмутаза.
В патогенезе нейродегенеративных заболеваний большое значение имеет эксайтотоксичность (от англ. excite- «возбуждать»). Этот термин, предложенный Джоном Олни в 1978 г., обозначает повреждение и гибель нейронов в результате избыточной активации рецепторов возбуждающего медиатора головного мозга - глутаминовой кислоты. Глутаминовая кислота активирует NMDA-рецепторы, регулирующие преимущественно вход ионов кальция.
Для активации NMDA-рецепторов необходимо связывание с двумя агонистами: глутаминовой кислотой и глицином В. Глицин выполняет функцию коагониста. Сайт связывания глицина на NMDA-рецепторе отличается от типичного рецептора глицина и не блокируется стрихнином. На этом этапе активации NMDA-рецептора из нейронов выходят ионы калия. Вход ионов кальция и натрия невозможен, так как ионные каналы закрыты ионами магния.
Полное открытие ионных каналов, регулируемых NMDA-рецепторами, происходит в результате деполяризации мембраны нейронов от -30 мв до -20 мв при участии AMPA-рецепторов и каинатных рецепторов соседних синапсов.
Эти рецепторы активируют вход в нейроны ионов натрия, что вызывает деполяризацию с последующим удалением Mg2+ из ионных каналов. Таким образом, NMDA-рецепторы являются потенциалозависимыми. Консолидированное функционирование каинатных, AMPA- и NMDA-рецепторов получило название долговременной потенциации.
В ответ на массивное поступление Ca2+ через каналы, активируемые NMDA-рецепторами, из митохондрий нейронов выделяется цитохром С, активируются свободнорадикальное окисление, каспазный каскад и протеинкиназа р38, повреждающая ДНК, повышаются образование NO и его превращение в пероксинитрильный радикал.
При болезни Паркинсона окисление дофамина при участии МАО В сопровождается продукцией перекиси водорода. В присутствии двухвалентного железа (в норме его количество в базальных ганглиях минимальное) перекись водорода превращается в свободные гидроксильные радикалы (рис. 22-1).
При недостаточности антиоксидантной защиты наступают дегенерация и гибель нейронов. В частности, у больных наследственной формой БАС значительно снижена активность супероксиддисмутазы.
Еще одним фактором, способствующим развитию нейродегенеративных заболеваний, служит нарушение процесса метилирования в коре больших полушарий и гиппокампе. При болезнях Паркинсона и Альцгеймера часто диагностируется гипергомоцистеинемия вследствие недостаточного превращения гомоцистеина в метионин или цистеин. Гомоцистеин активирует перекисное окисление липидов, апоптоз нейронов, усугубляет эксайтотоксичность.
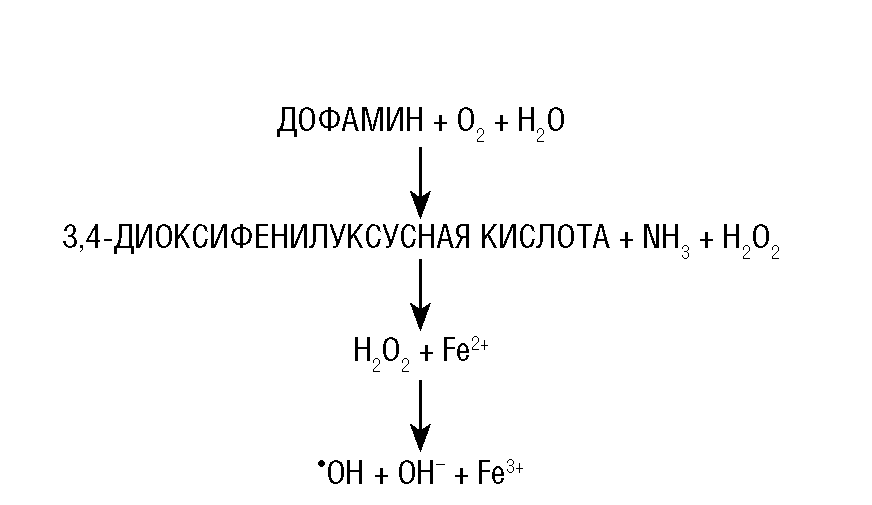
Рис. 22-1.Образование свободных радикалов при окислении дофамина
Дата добавления: 2016-02-20; просмотров: 1246;
