Иммуноглобулин обычно не предупреждает болезни, а только отодвигает срок заболевания, в значительной степени смягчает его тяжесть и предупреждает летальный исход.
В СССР для специфической профилактики применяется противокоревая живая вакцина из штамма Ленинград-16. Ее вводят подкожно однократно.Пикорнавирусы
Семейство Picornaviridae включает большое количество очень мелких (pico - маленький) РНК-содержащих вирусов. Все они – безоболочечные вирусы, размером 20-30 нм, устойчивые к эфиру и другим растворителям липидов. Пикорнавирусы, имеющие значение для человека, это прежде всего энтеровирусы, паразитирующие в кишечном тракте и риновирусы, которые инфицируют слизистую оболочку носа. Два других рода пикорнавирусов имеют значение для ветеринарии – афтовирусы, вызывающие ящур крупного рогатого скот и кардиовирусы мышей, включая вирус энцефаломиокрадита.
ЭНТЕРОВИРУСЫ
Энтеровирусы включают: полиовирусы типа 1-3, вирусы Коксаки A - типы 1-24 (тип 23 аналогичен ECHO 9), вирусы Коксаки B - типы 1-6, ECHO вирусы типы 1-34 (ECHO 10 теперь классифицируется как реовирус 1 типа, ECHO 28- как риновирус IA, и ECHO 34 как Коксаки A 24) и энтеровирусы типов 68-72.
Полиомиелит был известен с давних времен как паралитическая болезнь детей (детский паралич). Однако только к концу от 19-ого столетия он был охарактеризован как самостоятельная нозологическая форма, способная вызывать эпидемии, при которых число скрытых бессимптомных инфекций значительно превышает число паралитических случаев. Landsteiner и Popper (1909) сообщили об экспериментальной передаче заболевания обезьянам путем ведения интрацеребрально взвеси спинного мозга от безнадежных больных полиомиелитом. Экспериментальное изучение болезни было ограничено тем, что обезьяны были единственными лабораторными животными, восприимчивыми к вирусу. Прогресс также тормозился догмой, в то время общепринятой, что полиовирусы строго нейтротропны и способны размножаться только в нервной ткани. Главным крупным достижением было обнаружение Эндерсом, Уэллером и Роббинсом (1949) способности полиовирусов размножаться в культурах клеток эмбрионов человека, не относящихся к нервной ткани, вызывая цитопатическое действие. Они были удостоены Нобелевской премии в знак признания основополагающей важности этого открытия в развитии вирусологии в целом.
Новый тип вирусов был выделен Долдорфом и Сиклсом (1948) из кала детей с паралитическим полиомиелитом, от которых был также выделен и полиовирус 1 типа. Вирус вызывал параличи у мышат-сосунков. Этот вирус был назван вирусом Коксаки, так как больные прибыли в Нью-Йорк из селения Коксаки. С тех пор было выделено много подобных вирусов из кала и зева больных с различными заболеваниями и здоровых. Их назвали вирусами Коксаки, разделенными на группы А и В на основании патологических изменений, развивающихся у мышат-сосунков.
Введение методов культуры тканей в вирусологическую диагностику привело к выделению нескольких цитопатогенных вирусов из кала как больных, так и здоровых людей. Они были названы вирусами «сиротками», поскольку они не могли быть связаны с каким-либо определенным заболеванием. Они теперь известны под описательным термином «enteric cytopathogenic human orphan - цитопатогенные человеческие вирусы-сиротки» (ECHO).
Классификация энтеровирусов на вирусы Коксаки и ECHO не совсем удовлетворяет, но названия стали так хорошо укоренились, что их нельзя уже было заменить. Поэтому было решено, что с 1969 г. любой новый идентифицированный энтеровирус не будет определяться в какую-либо из этих групп, а были просто назначены номера типов энтеровирусов, начиная с 68 типа (потому что 67 типов энтеровирусов уже к тому времени были классифицированы - три типа вирусов полиомиелита, 30 – вирусов Коксаки и 34 – вирусов ECHO). Следовательно теперь есть пять новых типов энтеровирусов, 68-72. Энтеровирус 72 - вирус, вызывающий инфекционный гепатит (гепатит типа A). Из-за его особого положения мы рассмотрим его в лекции по гепатитам.
Большинство энтеровирусов специфично для хозяев, поражают один или несколько родственных видов. Нет общего группового антигена для энтеровирусов, хотя некоторые из них обнаруживают перекрестные антигенные реакции.
Полиовирусы
Морфология. Вирион - сферическая частица, примерно 27 нм в диаметре, капсид образован 60 субъединицами (капсомерами), каждая из которых состоит из четырех белков (VP1-VP4). Вирус имеет кубическую симметрию. Геном – однонитчатая РНК. Вирус может кристаллизоваться, и в цитоплазме инфицированных клеток может быть обнаружено множество вирусных кристаллов.
Устойчивость.Полиовирус стоек к эфиру, хлороформу, желчи, протеолитическим ферментам кишечного содержимого и детергентам. Он устойчив при pH 3, может выживать в течение месяцев при 4 ºС и несколько лет в при –20 ºC. В зависимости от условий – температуры, влажности, pH и количества вируса, его выживание в кале при комнатной температуре может меняться от одного дня до нескольких недель. Вирус полностью инактивируется при высокой температурой (при 55 ºC - в течение 30 минут). Молоко или мороженое обеспечивают защиту вируса. Формальдегид и дезинфицирующие средства–окислители разрушают вирус. Хлорирование уничтожает вирус в воде, но органические вещества задерживают инактивацию. Фенольные дезинфицирующие средства не эффективны. Полиовирус плохо переносит лиофилизацию.
Антигенные свойства.По реакции нейтрализации штаммы полиовирусов разделены на три типа, 1, 2 и 3. Тип 1 наиболее распространен и вызывает большинство эпидемий. Внутри типов в реакции нейтрализации выявляется различие между штаммами, но они несущественны для развития иммунитета против заболевания. Вирусы имеют общий комплементсвязывающий антиген.
Круг хозяев и культивирование. Естественная инфекция происходит только у людей. Обезьяны могут быть инфицированы экспериментально при заражении интрацеребрально или в спинной мозг. Шимпанзе и обезьяны циномольгус могут быть инфицированы также перорально. Некоторые музейные штаммы были адаптированы к размножению в грызунах и куриных эмбрионах цыпленка, но свежеизолированные вирусы не развиваются в них.
Вирус легко культивируется в различных культурах клеток приатов. Первичные культуры почек обезьяны используются для диагностического культивирования и вакцинного производства. Инфицированные клетки округляются, сокращаются и становятся пикнотичными. В окрашенных препаратах могут быть обнаружены эозинофильные внутриядерные включения. В зараженном монослое под агаровым или бентонитовым покрытием развиваются хорошо оформленные бляшки.
Патогенез.
Единственный естественный источник полиовируса - человек. Вирус распространяется непосредственно от человека к человеку без промежуточного хозяина. Резервуар инфекции состоит из людей, выделяющих вирус с фекалиями и, редко, с отделяемым ротоглотки.
Все энтеровирусы выделяются в больших количествах из кишечника: передача инфекции облегчается несоблюдение норм гигиены и санитарии. Наиболее часто происходит прямая передача руками, но фактором передачи могут быть также посуда и пищевые продукты или напитки. Иногда может происходить заражение через коньюнктиву глаз. Вспышки чаще происходят в закрытых коллективах и школах.
В острой фазе инфекции вирус находится в горле и, хотя в это время возможна капельная передача, обычным является фекально-оральный путь. После острой фазы он является единственно возможным. Наиболее высокая заразительность бывает в последние дни инкубационного периода, на 7 – 10 день после заражения, но передача инфекции может происходить значительно более длительный период, часто в течение нескольких недель, за счет выделения вируса с фекалиями.
Все энтеровирусные инфекции развиваются так, как это показано на рисунке 2 для полиовируса: у различных представителей группы имеются, конечно, различия в органах-мишенях, например центральная нервная система, кожа или мышцы. Из-за потенциальной серьезности инфекции и наличия модели на животных, больше всего изучен полиомиелит, хотя вероятно предполагать, что такие же особенности обнаруживаются и у с вирусов ECHO и Коксаки.
После попадания вируса в рот идет его размножение вначале в лимфоидной ткани миндалин или Пейеровых бляшек тонкой кишки и затем в регионарных лимфатических узлах, например, шейных и кишечных. В летальных случаях, при скоропостижной смерти, обнаруживаются набухшие и воспаленные Пейеровы бляшки и кишечные лимфоузлы, содержащие большие количества вируса.
Вирус, выходящий из лимфоузлов, поступает в кровь и затем в центральную нервную системунепосредственно или после размножения в лимфоидной ткани. Паралитический эффект полиовируса связан с поражением двигательных нейронов в передних рогах спинного мозга или бульбарных центрах. Локализация в мотонейронах, очевидно, обусловлена присутствием в них рецепторов для полиовируса. В пределах головного и спинного мозга распространение вируса может происходить непосредственно по соседним клеткам или через цереброспинальную жидкость к более отдаленным областям.
Фаза виремии знаменует конец инкубационного периода и проявляется лихорадкой и симптомами общей интоксикации. После периода около 48 часов 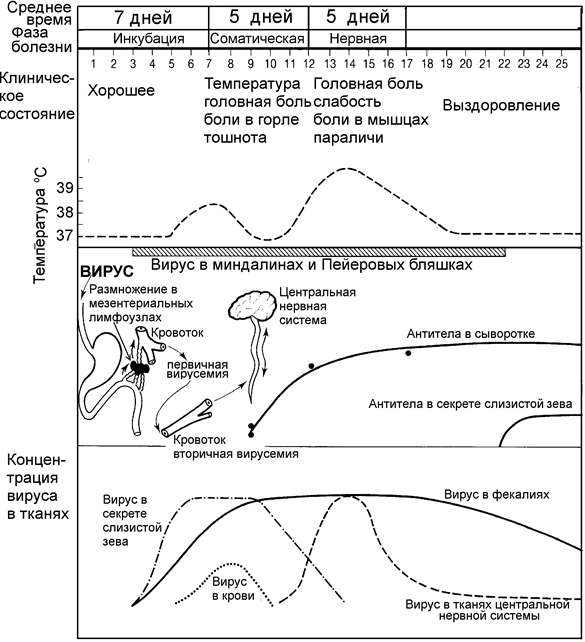
Рис. 2. ПАТОГЕНЕЗ ПАРАЛИТИЧЕСКОГО ПОЛИОМИЕЛИТА
относительно хорошего состояния (заболевание двухфазное) вирус проникает в нервную ткань и затем, в тяжелых случаях появляются признаки паралича. Наличие виремии доказано при экспериментальной инфекции у обезьян и несколько раз обнаруживалась у людей. Вероятно, процесс может быть остановлен на разных стадиях, причем вирус может размножаться в кишечнике без проникновения в кровоток. Если в крови присутствуют антитела, вирус может не достигнуть центральной нервной системы.
Энтеровирусы обладают литическим действием и уничтожают инфицированную клетку за нескольких часов или дней. Они не имеют вторичной оболочки, так что вряд ли способны стимулировать ответы цитотоксических T-клеток. Тем не менее, повреждение клеток вызывает воспалительную реакцию, а развивающийся отек может влиять и на неинфицированные вирусом нейроны. Однако, поскольку отек со временем проходит, функция этих клеток восстанавливается, чем и объясняется снижение выраженности параличей в течение недель или месяцев после острой стадии.
Экспериментально, показано, что вирус может продвигаться по нервам. В большинстве случаев, вероятно это не является основным путем распространения к центральной нервной системе, но может объяснять повышенный риск паралича, связанный с мышечной активностью, тонзиллэктомией и применением адьювантных вакцин.
Вследствие широко распространенного применения вакцин против полиомиелита, начиная с 1950-ых годов в Западной Европе, на Североамериканском континенте и в Австралии, полиомиелит, который был эндемичным в этих странах, фактически исчез, и случаи заболевания в этих регионах обычно были в результате заражения в других регионах, типа тропиков, где болезнь все еще эндемична. Количество зарегистрированных случаев значительно меньше истинной распространенности болезни, и в Индии и странах Африки все еще наблюдается высокий уровень заболеваемости. В других странах с низким охватом иммунизацией, типа Алжира и Марокко, продолжаются случаи заболевания с пиком заболеваемости каждые несколько лет. В тропиках болезнь наблюдается в течение всего года равномерно, без какой-либо тенденции к сезонным колебаниям.
До использования вакцин болезнь была эндемична у маленьких детей с периодическими эпидемиями, обычно поздним летом в Европе, Америке и Австралии. Там, где санитарно-гигиенические нормы соблюдаются, распространение вируса затруднено и отдельные лица и целые коллективы много лет свободны от инфекции. Таким образом, большая часть населения может не иметь никакого иммунитета, и когда заносится вирус полиомиелита, эпидемия может быстро распространяться. В 1978 в Нидерландах среди религиозной группы в 70 000 лиц, которые отказались от иммунизации, была вспышка в 110 случаев полиомиелита, из которых у 80 заболевших развился паралич,. Вдобавок к этим случаям заболевания, полиовирус 1 типа был выделен также из фекалий 70 % контактных непривитых, но не выделялся от привитых лиц.
ECHO- и Коксаки-вирусные инфекции эпидемиологически подобны полиомиелиту, хотя нет доступных вакцин для профилактик этих инфекций. Конечно, серотипов этих вирусов существует намного больше, и, хотя иммунитет создается к каждому типу вируса, последовательные волны инфекции с преобладающим типом отмечаются с интервалом в 1 или несколько лет. Даже в годы эпидемических вспышек обнаруживаются также и другие типы вирусов, хотя и не так часто, как эпидемический тип. Большинство инфекций выявляется у детей, часто как вспышки в детских садах и яслях. Заболевания у взрослых могут быть спорадическими в результате заражения при контакте с детьми.
Зараженность может достигать 100 % в закрытых коллективах и семьях, особенно если заражаются дети. Имеют значение также социальные факторы, типа соблюдения гигиенических норм, скученности и возраста контактирующих. Сточные воды могут содержать полиовирусы, особенно, когда среди населения имеется инфекция. Энтеровирусы могут выживать в течение нескольких месяцев в речной воде, но маловероятно сохранение вируса в хлорированной воде или воде плавательных бассейнов, в которых достигается рекомендованный уровень хлорирования (в отсутствии белкового загрязнения). Сезонная связь с летом и осенью не всегда обнаруживается, поскольку вспышки наблюдались зимой среди эскимосов, но это, вероятно, является результатом изоляции людей и недостаточности их иммунитета к многим вирусам. Вирусы обнаруживаются у мух и тараканов, но их роль в передаче инфекции минимальна. Тесный контакт и гигиенические условия остаются наиболее важными факторами.
Иммунитет. После перенесенной инфекции развивается длительный иммунитет. Вируснейтрализующие антитела формируются рано в течение болезни (часто до 7-го дня) и сохраняются в течение нескольких десятилетий. Вирусы 1 и 2 типов создают некоторый перекрестный иммунитет друг к другу.
Лечение. Специфической терапии энтеровирусных инфекций нет. Ранее было испытано большое число антивирусных агентов для лечения паралитического полиомиелита, но они не имели никакой практической ценности из-за быстрого появления устойчивости к лекарственным средствам.
Профилактика.
Активная иммунизация против полиовирусной инфекции может проводиться:
1. Инактивированной полиомиелитной вакциной (Солка)
2. Живой ослабленной полиомиелитной вакциной (Себина).
Инактивированная полиомиелитная вакцина (ИПВ) Солка была применена для широкой иммунизации в 1956 г.. Вакцина содержит штаммы трех типов вируса, которые выращивают в культуре клеток почек обезьян и инактивирована формалином. Партии вакцины проверяются на присутствие остаточного живого полиовируса и должны быть свободны от бактерий, грибов, микоплазм и вируса SV40 (обезьяний вирус 40), который является онкогенным для хомячков. Инактивированные вакцины используются почти исключительно в Швеции, Финляндии, Исландии и Голландии. С достижением охвата вакцинацией более 90 % эти страны фактически устранили циркуляцию полиовируса. Циркуляция полиовируса, среди населения была резко снижена, несмотря на то, что инактивированная вакцина не вызывает выработки секреторных IgA в пищеварительном тракте. Высокий уровень охвата иммунизацией является необходимым для поддержания достаточного уровня антител, так как было установлено, что заболеваемость прямо связана с уровнем антител к вирусу во время заражения.
Вакцина должна применяться путем глубокого подкожного или внутримышечного введения и не дает местных или общих реакций. Курс из трех инъекций с интервалами 6-8 недель между первой и второй дозами и 4-6 месяцев между второй и третьей создает длительный иммунитет к всем трем типам полиовируса. Инактивированная вакцина рекомендуется для иммунокомпрометированных лиц и контактирующих с ними, а также для всех, кому противопоказано введение живой вакцины.
ИПВ может использоваться одновременно с вакциной против дифтерии, коклюша и столбняка. Ревакцинацию можно проводить одновременно с вакциной против дифтерии и столбняка, а также с ассоциированной вакциной против паротита, кори и краснухи.
Живая ослабленная полиомиелитная вакцина (ЖВП). А. Себин в США получил ослабленные варианты вирусов полиомиелита. Из них А.А.Смородинцев и М.П.Чумаков в конце 1950-х годов получили живую полиолмиелитную вакцину для орального применения. Она содержит живые но ослабленные штаммы полиовируса типов 1, 2 и 3, выращенные в культурах клеток почки обезьяны или диплоидных клеток человека. Штаммы были получены путем культивирования выделенных «диких» (выделенных из естественных источников) маловирулентных вирусов полиомиелита и селекции штаммов, потерявших нейровирулентность.
Вакцина применяется перорально и аналогично естественной инфекции вызывает образование и местных секреторных IgA в глотке и пищеварительном тракте и циркулирующих IgG, вызывая таким образом местную устойчивость к последующей инфекции дикими вирусами полиомиелита. Коллективный иммунитет важен в предотвращении циркуляции вируса дикого типа, и необходим высокий уровень охвата иммунизацией. Этому помогает широкая циркуляция вакцинного вируса, который помогает поддерживать иммунитет среди населения. Однако, вакцинные штаммы не являются стабильными, и изучение последовательных изолятов вируса от вакцинированных лиц свидетельствует о том, что что изменения вакцинных вирусов быть обнаружены очень быстро. Поэтому имеется теоретическая возможность того, что вакцинный вирус, ослабленный последовательным пассажем культуре клеток, может снова приобрести нейровирулентность в результате многократных циклов репликации у вакцинированных и после передачи контактным лицам.
Случаи полиомиелита, ассоциирующегося с вакцинацией, были выявлены у получивших ЖПВ в дозе 1 - 2 миллиона, такие случаи были также обнаружены и у контактных.
Невозможно предсказать, кто будет поражен, хотя следует предупредить расширенную репродукцию вируса у иммунокомпрометированных лиц, поскольку риск вакцино-ассоциированного полиомиелита у таких людей в 10 000 раз выше, чем у нормальных лиц. Поэтому не-иммунизированные родители и члены семьи, контактирующие с детьми, получающими первичную вакцинацию, должны быть иммунизированы против полиомиелита одновременно с детьми.
ЖПВ рекомендуется для детей с 3-х месячного возраста ( в Великобритании – с 2-х месяцев). Первичный курс состоит из трех отдельных доз, дающихся одновременно с вакциной АКДС. Каждая доза содержит все три штамма. Младенцам капают три капли на ложку непосредственно в рот, который может быть открыт в ответ на одновременное введение внутримышечно или подкожно вакцины АКДС. Грудное вскармливание не мешает гуморальному иммунному ответу на ЖПВ и должно продолжаться. Ревакцинация проводится при поступлении в школу, но она не является необходимой для взрослых, если только нет особого риска, как например при путешествии или профессиональном риске. Эффективность живой вакцины очень высока.
Если выявляется случай паралитического полиомиелита, дозу ЖПВ нужно давать всем иммунокомпетентным лицам в непосредственном окружении, независимо от сведений о предыдущей вакцинации против полиомиелита. Неиммунизированным лицам вакцинация должна проводиться полным первичным курсом. Если источник вспышки неясен, ее следует считать вызванной вирусом «дикого типа», пока не доказано иное.
ДНК - СОДЕРЖАЩИЕ ВИРУСЫ
1. ОБЩАЯ ХАРАКТЕРИСТИКА ДНК-ГЕНОМНЫХ ВИРУСОВ
Патогенные для человека ДНК-геномные вирусы входят в состав 6-ти семейств: ADENOVIRIDAE, HERPESVIRIDAE, POXVIRIDAE, PAPOVAVIRIDAE, HEPADNAVIRIDAE и PARVOVIRIDAE. Эти вирусы генетически более консервативны, чем РНК-геномные вирусы, менее изменчивы.
Для них характерна способность к длительной персистенции в организме человека, что нередко связано с интеграцией их генома с клеточным. Все названные семейства включают вирусы с двунитевой ДНК, за исключением парвовирусов, у которых ДНК однонитчатая. Аденовирусы, паповавирусы и парвовирусы - безоболочечные (суперкапсид отсутствует), герпесвирусы, поксвирусы и гепаднавирусы имеют внешнюю оболочку. На этой лекции мы не будем касаться гепаднавирусов и паповавирусов, так как они будут предметом рассмотрения на следующей лекции. Среди остальных ДНК-геномных вирусов наибольшее значение для медицине в настоящее время имеют герпесвирусы и аденовирусы, поэтому им мы уделим основное внимание в этой лекции. Раньше при рассмотрении ДНК-геномных вирусов в первую очередь обращали внимание на поксвирусы, так как к ним относился вирус натуральной оспы и вирус осповакцины. Мы коснемся этого вопроса лишь вкратце.
2. ПОКСВИРУСЫ
К поксвирусам, патогенным для человека, относятся вирус натуральной оспы, вирус осповакцины (вирус оспы коров), а также вирусы оспы обезьян и сходные с ними вирусы Яба и контагиозного моллюска, считающиеся онкогенными вирусами.
Вирус натуральной оспы - возбудитель особо опасного заболевания, которое на протяжении нескольких тысячелетий давало пандемии с высокой смертностью населения. В настоящее время благодаря усилиям мирового сообщества это заболевание полностью ликвидировано на Земле. В 1958 году по предложению советской делегации ВОЗ приняла резолюцию о глобальном искоренении ил для выполнения этой программы 1,5 млрд. прививочных доз оспенной вакцины, активно работали советские специалисты. Натуральная оспа была ликвидирована в результате массовой вакцинации всего населения в остававшихся очагах оспы в Африке и Индии. В 1975 году был зарегистрирован последний случай натуральной оспы в Бангладеш, а в 1976 году - в Сомали. В настоящее время отменена обязательная вакцинация против натуральной оспы. По некоторым данным, на программу по ликвидации натуральной оспы мировое сообщество затратило средства, равные стоимости одного стратегического бомбардировщика.
Поскольку ликвидация натуральной оспы - первый опыт искоренения инфекционного заболевания, мы не можем в полной мере прогнозировать полное исчезновение возбудителя и невозможность его возврата. Поэтому мы должны знать о вирусе натуральной оспы и методах диагностики и профилактики этого заболевания. соответствующий материал имеется в учебниках и будет Вами рассмотрен на практических занятиях.
Необходимо учитывать также то, что сохраняется циркуляция вирусов оспы животных, в частности - оспы обезьян. Имеются случаи заболевания людей оспой обезьян, это заболевание не только напоминает по симптомам легкую форму натуральной оспы, но и передается от человека к человеку воздушно-капельным путем. Не исключается возможность того, что вирус оспы обезьян может послужить основой для возникновения новой формы вируса оспы, высоко патогенного для человека. Последствия этого могут оказаться катастрофическими, поскольку не будет иммунной прослойки населения - нет вакцинации и нет заболеваемости в той мере, которая может обеспечивать коллективный иммунитет. Все это заставляет нас быть постоянно настороже.
Вирус осповакцины, очень близкий по биологическим свойствам к вирусу натуральной оспы и практически идентичный с ним по антигенной структуре, в настоящее время служит основой для конструирования некоторых генно-инженерных антигенных препаратов.
3. ГЕРПЕСВИРУСЫ
Герпесвирусы получили название от греческого слова herpes -ползучая. Они поражают широкий круг хозяев.
Вирионы герпесвирусов обычно имеют сферическую форму с диаметром 140-210 нм. Это - оболочечные вирусы. Их нуклеокапсид имеет кубический тип симметрии. Геном представлен двунитчатой ДНК из двух ковалентно связанных фрагментов. В геноме имеется 80 генов. Капсид имеет форму икосаэдра, содержит 162 капсомера. Капсид окружен липопротеидной вторичной оболочкой с шипиками на поверхности. Шипики образованы гликопротеидами. В состав вирионов входит более 30 белков. В инфицированных клетках обнаруживаются еще около 20 вирусспецифических белков, неструктурных, т.е. не входящих в состав вирионов.
Белки нуклеокапсида являются группоспецифическими антигенами, выявляемыми в реакции преципитации. Типоспецифические антигены герпесвирусов связаны с гликопротеидами внешней оболочки, они выявляются в реакции нейтрализации, РСК, РИФ и ИФА.
Герпесвирусы культивируются в культурах клеток. ЦПД герпесвирусов проявляется в образовании гигантских многоядерных клеток. Вирусы проникают в чувствительные клетки путем рецепторного эндоцитоза, во время которого вирус освобождается от суперкапсида, нуклеокапсид транспортируется в ядро, где происходит его депротеинизация. Формирование вирионов происходит в ядре, в котором образуются внутриядерные эозинофильные включения. Выход вируса из ядра происходит путем почкования через ядерную мембрану с формированием вторичной оболочки. Затем по эндоплазматической сети вирионы транспортируются в аппарат Гольджи, где окончательно формируются гликопрoтеиды внешней оболочки, после чего вирусы выносятся на поверхность клетки в составе транспортных везикул.
Патогенез заболеваний. Вирусы герпеса обладают полиорганным тропизмом и способностью длительно персистировать в организме хозяина. При этом вирус сохраняется в клетках в форме провируса (в виде вирусного генома, интегрированного в геном клетки). Кроме того, возможна пожизненная персистенция вирусов герпеса в форме двунитчатых кольцевых форм ДНК в нейронах, например - тройничного нерва. Это приводит к развитию хронической и латентной инфекции. Некоторые вирусы герпеса передаются трансплацентарно, вызывают внутриутробные инфекции.
Все герпесвирусы обладают иммуносупрессивным действием, подавляют функцию как Т-, так и В- систем иммунитета.
Семейство HERPESVIRIDAE включает три подсемейства: Alphaherpesvirinae, Betaherpesvirinae и Gammaherpesvirinae.
Альфа-герпесвирусывключают вирусы простого герпеса (І и ІІ типов: ВПГ-1 и ВПГ-2) и вирус ветряной оспы - опоясывающего герпеса (herpes zoster).
Вирусы простого герпеса имеют общие групповые антигены и типоспецифические антигены. Их выявляют в РН, РИФ, ИФА. Основные отличия между вирусами - в характеристике вызываемых ими заболеваний.
ВПГ-1 вызывает острый гингивостоматит, фарингит, афтозный стоматит, герпетическую экзему, кератоконьюнктивит, менингоэнцефалит. Ребенок обычно переносит в раннем детстве герпетический стоматит и фарингит, а в последующем развивается латентная инфекция с обострениями в виде высыпаний на крыльях носа и губах - herpes labialis. Заражение происходит воздушно-капельным путем и через предметы обихода, загрязненные слюной больных и носителей инфекции.
Наиболее опасная форма герпетической инфекции из наиболее часто встречающихся форм - герпетический кератит, который приводит к глубокому поражению роговицы и нарушению зрения. Герпетические менингиты и энцефалиты протекают очень тяжело, являются результатом генерализации инфекции вследствие несостоятельности иммунной системы, но, к счастью, встречаются редко.
При герпетической инфекции в крови появляются антитела к вирусу герпеса, однако они не обеспечивают ни удаления вируса из организма, ни рецидивов болезни. Антитела к ВПГ-1 обнаруживаются у 70-90 % взрослых.
ВПГ-2вызывает половой герпес и герпес новорожденных. Он передается от больных и носителей половым путем и распространяется как венерическая болезнь. Новорожденные заражаются во время родов. Генитальный герпес характеризуется везикулярным поражением мужских или женских половых органов и чаще встречается у лиц половозрелого возраста. Заболевание протекает хронически с периодическими обострениями. В настоящее время отмечается высокая частота генитального герпеса, что связано как с его широким распространением, так и с возросшими возможностями современной диагностики.
У новорожденных герпетическая инфекция встречается редко, по данным зарубежных авторов - от 1 на 3000 до 1 на 20000, но протекает очень тяжело с высокой летальностью и тяжелыми неврологическими и глазными осложнениями.
Лечение герпетической инфекции проводят ацикловиром и его современными производными. При хронических рецидивирующих формах инфекций обоими типами вирусов с успехом используют инактивированную герпетическую вакцину. Ее готовят в Одесском НИИЭВ им. И.И.Мечникова. Специфическая профилактика не разработана.
Диагностика осуществляется по общим принципам вирусологической диагностики: цитологическое исследование мазков-отпечатков и осадков ликвора (наличие гигантских многоядерных клеток с внутриядерными включениями), РИФ; выделение вируса на куриных эмбрионах и культурах клеток, серодиагностика (прирост антител в парных сыворотках в РСК и ИФА).
Вирус ветряной оспы и опоясывающего герпеса вызывает названные два заболевания. Вирус полностью соответствует характеристике вирусов герпеса.
Ветряная оспа - обычно относительно легко протекающая инфекция с папулезно-везикулярными высыпаниями на коже и слизистых. Ветряная оспа - одно из самых распространенных заболеваний человека. Наиболее восприимчивы дети от 2 до 6 лет, но заболевают и взрослые. Отмечается преимущественно зимой и весной.
Болезнь передается воздушно-капельным путем и, реже, контактным путем в результате вскрытия везикул. Инкубационный период длится 14-21 день. После нескольких дней продромального периода везикулярная сыпь появляется вначале на туловище, а затем на лице и конечностях. Обычно заболевание заканчивается выздоровлением с формированием пожизненного иммунитета. Ветряная оспа у новорожденных протекает значительно тяжелее и у 20 % заканчивается смертельным исходом. Ветряная оспа у женщин в первые три месяца беременности может приводить к врожденным уродствам у плода.
При опоясывающем герпесе после недомогания и повышения температуры возникают сильные боли по ходу нервов. Через несколько дней на этих участках появляются высыпания, например - по ходу интеркостальных нервов.
В США ежегодно регистрируется 600 тыс. новых пациентов с герпес жостер. Инфекция в виде ветрянки начинается в раннем детском возрасте, но вирус не покидает организм, а персистирует в ганглиях спинного мозга. При снижении сопротивляемости организма (изменение температуры - похолодание или потепление на улице, опухолевый процесс, СПИД, иммунодепрессивная терапия и др.) латентная инфекция обостряется. Это особенно характерно для пожилого возраста - после 50-ти. По данным американских и австралийских исследователей у 1/3 лиц после 55 лет и старше опоясывающий лишай осложняется постгерпетическими невритами очень тяжело переносящимися и плохо поддающимися терапии.
Ацикловир, эффективный против простого герпеса, мало помогает при герпес жостер.
В настоящее время - сдвиг в лучшую сторону. Появились производные ацикловира, более эфективные при герпес жостер, например - ванцикловир.:
года получено разрешение на применение в лечебной практике ванцикловира, это свидетельствует о высокой эффективности и безвредности, т.к. в США трудно получить разрешение на регистрацию препарата. Применение этого препарата на 2 месяца укорачивает постгерпетические невриты при приеме 7 дней три раза в день. Эти препараты рассматриваются как пролекарства. Они вводятся в неактивной форме, активируются в организме, что дает меньше побочных эффектов. Они лучше подавляют вирусную репродукцию, чем ацикловир. Другое направление - использование ганглиоблокаторов для снижения болевого синдрома.
Бета-герпесвирусывключают цитомегаловирус (ЦМВ). Этот вирус сходен с вирусом простого герпеса, но имеет более продолжительный цикл репродукции, культивируется в ограниченном числе культур клеток (обычно для культивирования используют культуры фибробластов эмбриона человека и диплоидные культуры клеток легких эмбриона человека, которые наиболее чувствительны к ЦМВ). Цитопатогенное действие ЦМВ очень характерно и проявляется в возникновении гигантских клеток из-за увеличения как цитоплазмы, так и ядра. В клетках содержатся крупные внутриядерные включения, состоящие из вирусных частиц и ядерного хроматина, окруженные светлым ободком. Обычно такие клетки называют «совиный глаз». Такого же типа клетки обнаруживаются и в исследуемом материале от больных - в осадках мочи, слюны, в пораженных тканях.
Различают два серотипа цитомегаловируса. Их дифференцируют в реакции нейтрализации.
Цитомегаловирусная инфекция широко распространена в мире. Антитела к ЦМВ обнаруживаются более чем у 80 % людей старше 35 лет. Более чем 20 % детей первых лет жизни выделяют ЦМВ с мочой и слюной.
Заражение происходит через слюну. Заболевание длится практически пожизненно в виде длительных ремиссий и обострений. Основные клинические проявления связаны с поражением центральной нервной системы, печени, легких. Наиболее опасна вертикальная передача ЦМВ от матери к плоду транплацентарно, что может приводить к преждевременным родам, врожденным дефектам развития плода. Вирус персистирует в слюнных железах.
Как и все герпесвирусы, ЦМВ обладает выраженной лимфотропностью, поражает иммунную систему с развитием вторичного иммунодефицита.
Разработаны живые вакцины из аттенуированных штаммов. Их применяют в виде моновакецины либо в составе дивакцины в сочетании с вакциной против краснухи.
Лечение проводят в основном ацикловиром, но он менее эффективен, чем при альфа-герпесвирусных инфекциях.
Кгамма-герпесвирусамотносится вирусЭпстайна Барр, который по основным свойствам не отличается от других представителей семейства герпесвирусов. Однако этот вирус обладает способностью вызывать не разрушение лимфоцитов, а размножение пораженных клеток - В-лимфоцитов. Он является В-лимфоторопным вирусом и способен к длительной персистенции в В-лимфоцитах. Мы используем свойство вируса стимулировать размножение В-лимфоцитов в биотехнологии, для получения моноклональных антител в культурах гибридом. Без этого вируса не происходит непрерывное размножение гибридомных клеток.
В странах умеренного климата вирус Эпстайна-Барр вызывает инфекционный мононуклеоз. Это детская капельная инфекция, хотя могут болеть взрослые. Заболевание характеризуется подъемом температуры, увеличением лимфоузлов и селезенки. В крови резко увеличивается число моноцитов и лимфоцитов. Обычно заболевание протекает относительно нетяжело и заканчивается выздоровлением.
В условиях тропиков вирус Эпстайна-Барр вызывает лимфому Беркитта (опухоль верхней челюсти у детей и подростков в странах Африки), а в Китае - назофарингеальную карциному (рак носоглотки). Вирус Эпстайна-Барр является одним из наиболее хорошо изученных онкогенных вирусов человека.
4. АДЕНОВИРУСЫ
Аденовирусы были выделены в 1953 году из культуры клеток миндалин детей, они вызывали дегенерацию аденоидной ткни. Поэтому вначале их называли АД-вирусами.
В настоящее время известно много типов аденовирусов, которые выделены в семейство Adenoviridae.
Это семейство включает два рода - Mastodenovirus (аденовирусы млекопитающих) и Aviadenovirus (аденовирусы птиц). Аденовирусы млекопитающих включают аденовирусы человека, обезьян, крупного рогатого скота и др.
Аденовирусы человека (49 типов) имеют форму икосаэдра диаметром 70-90 нм. Их капсид построен из 252 капсомеров диаметром 7-9 нм. 240 капсомеров образуют собственно капсид, от 12 вершин которого отходят выступы (фибры - нити) длиной от 8 до 20 нм, на конце которых находятся утолщення - капсомеры диаметром 4 нм. Их называют пентонами. Внутри капсида находится дезоксирибонуклеотид вируса в виде организованой структуры с 12 петлями соответственно 12 вершинам икосаэра. Таким образом, аденовирусы имеют кубический тип симметрии и лишены суперкапсида. Соответственно аденовирусы не имеют липидов. В составе аденовирусов есть гликопротеиды в составе фибр. Геном аденовирусов имеет размеры 20-25х106.
Аденовирусы обладают гемагглютинирующей активностью, которая связана с гликопротеидами пентонов. В зависимости от свойства аденовирусов агглютинировать эритроциты разнообразных видов животных выделяют три подгруппы аденовирусов. Типоспецифическая идентификация большинства аденовирусов проводится в РТГА.
Аденовирусы более стойки во внешней среде, чем другие вирусы человека, они выдерживают прогревание при 50 °С.
Аденовирусы культивируются в первичных культурах клеток почек эмбриона человека, клетках НеLa и др. ЦПД аденовирусов проявляется в дегенерации клеток с нарушением целостности монослоя, часто создаются скопления клеток в виде гроздьев винограда, в клетках обнаруживаются внутриядерные включения аденовирусов.
Цикл репродукции аденовирусов в клетках продолжается 14-24 часов. Аденовирусы адсорбируются на клеточных рецепторах фибрами и проникают внутрь клеток путем рецепторного эндоцитоза. Депротеинизация начинается еще в цитоплазме, а заканчивается в ядре. Транскрипция и репликация вирусного генома происходит также в цитоплазме, а заканчивается в ядре. Транскрипция и репликация вирусного генома происходит при помощи клеточных ферментов. Сборка вирионов происходит в ядре, где формируются кристаллоподобные образования из полноценных вирионов и пустых капсидов, лишенных ДНК. Выход аденовирусов сопровождается разрушением клетки. В одной клетке может создаваться до миллиона вирионов, и только небольшая часть из них (несколько сотен) выходит из клетки, основная масса остается связанной с ядром разрушенной клетки.
Аденовирусы могут интегрировать свой геном в клеточный геном. Некоторые аденовирусы обладают онкогенними свойствами, которые проявляются в культурах клеток и при заражении лабораторных животных. Онкогенность аденовирусов для человека не доказана.
Патогенез заболевания у человека. Заражение происходит от людей с острой или латентной аденовирусной инфекцией. Главным путем передачи является воздушно-капельный, возможна передача через предметы обихода и воду бассейнов.
Аденовирусы размножаются в эпителии слизистой верхних дыхательных путей, в конъюнктиве глаза и лимфоидной ткани миндалин. Аденовирусы 40 и 41 типов вызывают гастроентериты, они попадают в организм фекально-оральним путем и размножаются первично в эпителии кишечника и мезентериальных лимфоузлах.
В результате болезни часто развивается вирусемия. При циркуляции вирусов в крови поражается эндотелий сосудов, что приводит к развитию воспалительных изменений слизистых с образованием фибринозных пленок и развитием некроза. Аденовирусы могут проникать через плаценту, вызывая внутриутробные поражения плода с аномалиями развития и последующими смертельными пневмониями новорожденных.
Аденовирусы являются одними из частых возбудителей острых респираторных вирусных инфекций (ОРВИ). Они вызывают фарингиты, ларингиты, трахеобронхиты. Характерно комбинированное поражение слизистых оболочек, аденоидов и конъюнктивы глаза (фаринго-конъюнктивальна лихорадка). Поэтому ранее аденовирусы называли «адено-фаринго-конъюнктивальные вирусы». Аденовирусные конъюнктивиты и кератоконъюнктивиты могут возникать в виде вспышек госпитальных инфекций.
Заболевания имеют осенне-зимнюю сезонность. Чаще поражаются дети в возрасте в 2 лет, с возрастом частота аденовирусных инфекций снижается.
В сыворотках переболевших сначала обнаруживаются антитела класса IgM, а потом IgG. В носовом секрете и отделяемом носоглотки появляются секреторные IgA, а также IgG-антитела.
Для профилактики и раннего лечения аденовирусных инфекций применяют лейкоцитарный интерферон, а также дезоксирибонуклеазу.
Получены живые и инактивированные аденовирусные вакцины из отдельных типов аденовирусов. Их достаточно широко применяют в США.
5. ПарвовирусЫ
Парвовирусы получили свое название от латинского слова parvus - маленький. Это действительно наименьшие ДНК-геномные вирусы. Размеры их вирионов всего 18-26 нм в диаметре. Их геном представлен однонитчатою ДНК с молекулярной массой 1,5-2,0 МДа. Вообще в разных вирионах содержатся или “плюс”, или “минус” - нити ДНК. Вирусы не имеют вторичной оболочки, а их капсид с икосаедральноq симметрией составлен из 32 капсомеров диаметром 3-4 нм каждый.
Парвовирусы относительно высокоустойчивы: они сохраняют инфекционные свойства в течение часа при 60 °С, не разрушаются органическими растворителями и детергентами и чувствительны к ультрафиолетовому облучению.
Парвовирусы подразделяются на две большие группы - недефектные вирусы, способные к самостоятельной репродукции в клетке (роды Parvovirus и Densovirus) и дефектные, которые репродуцируются только в присутствии вируса-помощника (род Dependovirus от лат. dependere - зависимый). Относительно недавно считали, что патогенными для человека являются только представители рода Dependovirus - аденоассоциированные вирусы или аденосателлиты.
Известно 5 серотипив аденосателлитов. Они выявлены во время выделения аденовирусов человека на культурах клеток. Все они имеют общий антиген, который проявляется в РИФ.
Репродукция этих вирусов происходит в ядре, она возможна только при участии вируса-помощника, причем транскрибируется только минус-нитевая ДНК.
Допускают, что присоединение аденассоциированных вирусов к основному заболеванию осложняет течение аденовирусных инфекций.
В последнее время установлено, что представители рода Parvovirus вызывают не только заболевания у млекопитающих, птиц и насекомых, но и патогенны для человека. Парвовирус, названный RA-1, обнаружен в фекальных массах и синовиальной оболочке суставов при ревматоидном артрите.
Наиболее патогенным для человека считают вирус В19, который признаётся возбудителем инфекционной эритемы, поражающей суставы, а также возбудителем хронической гемолитической анемии. Вирус выделен из крови больных.
Заражение этим вирусом происходит воздушно-капельным путем, после чего вирус репродуцируется в клетках респираторного эпителия. Потом вирус попадает в кровь и основная его репродукция происходит в ядрах клеток костного мозга. Вирус поражает эритробласты и ретикулоциты, имеет тропизм в эндотелию сосудов.
Считают, что этот вирус обладает эмбриопатическим действием и может быть причиной поражения плода и мертворождений.
Инфекция вирусом В19 распространенная широко. Антитела к вирусу отмечаются у 60 % взрослого населения.
Лабораторная диагностика парвовирусных инфекций основывается на выявлении вирусного антигена в пораженных клетках при помощи РИФ, на определении вирусной ДНК методом молекулярной гибридизации, а также на определении повышения титров антител в парных сыворотках.
Лечение и профилактика этих инфекций до сих пор не разработаны.
РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
1. Медична мікробіологія, вірусологія та імунологія : підручник для студ. Вищ. Мед. Навч. заклад. / За редакцією В.П.Широбокова/ Видання 2-е. – Винниця : Нова книга, 2011. – 952 с.
2. Протченко П.З. Загальна мікробіологія, вірусологія та імунологія. Вибрані лекції: Навч. посібник . – Одеса: Одес. Держ. мед. ун-т, 2002. – 298 с.
3. Пяткін К. Д., Кривошеїн Ю.С. Мікробіологія. - К : Высшая школа, 1992. - 432 с.
Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология. - М : Медицина, 1983. - 312 с.
4. Борисов Л.Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии / под ред. Борисова Л.Б. – Г. : Медицина, 1993. – 232 с.
5 Медицинская микробиология, вирусология и иммунология: Учебник под ред. А.А.Воробьева. – М.: Медицинское информационное агентство, 2004. - 691 с.
6. Медицинская микробиология, вирусология, иммунология /ред. Л.Б. Борисов, А.М. Смирнова. - М: Медицина, 1994. - 528 c.
5. Букринская А.Г. Вирусология. – М.:Медицина, 1986. – 336 с.
Лекция 24.ВИРУСЫ ГЕПАТИТОВ.
РЕТРОВИрусы.
ОНКОГЕННЫЕ ВИРУСЫ
1. Вирусы гепатитов
Термин «вирусный гепатит» относится к первичной инфекции печени любым представителем разнородной группы «вирусов гепатита», которая в настоящее время состоит из вирусов гепатита типов A, B, C, D и E (таблица 1), а также ожидающих подтверждения типов F и G. Единственное общее свойство вирусов гепатита - их первичный гепатотропизм. В других отношениях они несходны. Кстати, гепатит может развиваться при инфекции многими другими вирусами, например, вируса желтой лихорадки, лихорадки Ласса, Марбург, вирусами Эпштейна-Барр, цитомегалии, простого герпеса, ветряной оспы-опоясывающего герпеса, кори, краснухи или Коксаки, но эти процессы не включаются в категорию вирусного гепатита.
По эпидемиологическим и клиническими критериями были выделены два типа вирусного гепатита.
Один тип встречается спорадически или во время вспышек, поражая главным образом детей и молодых лиц, и, очевидно, передается фекально-оральным путем. Он назывался ранее инфекционным гепатитом, болезнью Боткина, а затем получил название гепатит типа А.
Второй тип вирусного гепатита, передающийся главным образом при инъекциях первоначально наблюдался у людей, получающих введение сыворотки или переливание крови. Он был известен под несколькими названиями типа поствакцинальный, посттрансфузионный, прививочный или сывороточный гепатит. Позже он был назван гепатит типа В.
Какое-то время считалось, что все вирусные гепатиты вызываются одним из двух вирусов гепатита, типа A, вызывающим все случаи инфекционного, и типа В - сывороточного гепатитов. Однако, с разработкой и применением методов для диагностики инфекции вирусами гепатитов А и В, стало очевидно, что во многих случаях инфекционного и посттрансфузионного гепатитов не обнаруживалось никаких доказательств инфекции вирусами гепатитов типов А и В. Поэтому стало очевидно, что клинический синдром гепатитов типа A или B мог быть вызван также одним или многими неописанными вирусными агентами. Для этой группы гепатитов применялся термин гепатит «ни-А ни-В».
2. ГЕПАТИТ ТИПА A ( Инфекционный гепатит)
Гепатит типа А – подострое заболевание повсеместного распространения, встречающееся, главным образом, у детей и молодых лиц. Вирус попадает в организм через рот и размножается в эпителии кишечника прежде, чем достигает печени гематогенным путем. Он выделяется с фекалиями в течение последних дней инкубационного периода и продромальной фазы болезни, но редко позже. После развития желтухи вирус редко обнаруживается в фекалиях. Вирус присутствует в крови в течение краткого периода во время преджелтушной стадии, но обычно исчезает, когда развивается желтуха. Он может иногда присутствовать в моче и слюне.Вирус A Гепатита (HAV)
Вирус был обнаружен в 1973 г. Фейнстоуном с соавт. в фекалиях экспериментально зараженных добровольцев при использовании метода иммунной
Таблица 1 . ОБЩАЯ ХАРАКТЕРИСТИКА ВИРУСНЫХ ГЕПАТИТОВ
| Гепатит | A | B | C | D | E |
| Предыдущее название | Инфекционный гепатит | Сывороточный гепатит | Часть гепатитов ни А ни B | Дельта -гепатит | Энтерально передающийся ни А ни B гепатит |
| Вирус, размеры | HAV, 27 нм, безоболочечный | HBV, 42 нм, оболочечный | HCV, 50-60 nm, оболочечный | HDV, 37 нм, безоболочечный | HEV, 22-30 нм, безоболочечный |
| Таксономия | Энтеровирус 72 типа (Heparnavirus) | Hepadnavirus | Сходен с флавивирусами | Сходен с вироидом | Сходен с калицивирусом |
| Тип нуклеиновой кислоты | РНК, односпиральная | ДНК, кольцевая, двухспиральная, одна спираль имеет разрыв | РНК, односпиральная | Дефектная кольцевая РНК | РНК, односпиральная |
| Обычные способы передачи | Фекальный - оральный | Через кожу, кровь и продукты крови, тканевые жидкости, наркомания, половой контакт; вертикальная передача. | Кровь и продукты крови | Кровь и продукты крови | Фекальный - оральный |
| Инкубация | 2-6 недель | 2 — 6 месяцев | 6 — 8 недель | Различная | 2-9 недель |
| Возрастнная группа | Дети | Любой возраст | Любой возраст | Любой возраст | Взрослые |
| Летальность | 0,6 % | 1,4 % | 1-2 % | 30 % | 1-2 % |
| Риск рака | нет | существует | существует | нет | нет |
| Географическое распространение | Во всем мире | Во всем мире | США, Европа, Япония, вероятно, во всем мире | Очаговое: часто в Центральной Америке, Средиземноморье. редко в Индии, Юго-Восточной Азии. | Распространяется в мире: Индийский субконтинент, Центральная и Ю-В Азия, Центральная и Южная Америка, Северная Африка. |
| Иммунизация | Активная, пассивная | Активная, пассивная | Нет | Против HBV | Нет |
Примечание:
1. Название «вирус гепатита F» было предложено для предполагаемого вирусного ответственного за ни B, ни C, не D гепатит, связанный с переливанием крови.
2. Парамиксовирус предположительно ответственный за синцитиальный гигантоклеточный гепатит, был временно обозначен как «вирус гепатита G».
электронной микроскопии (ИЭМ). Экспериментальная инфекция может быть воспроизведена у шимпанзе и южноамериканских мартышек. Вирус можно культивировать в некоторых культурах клеток человека и обезьян.
HAV – безоболочечный РНК-содержащий вирус размером 27 нм, принадлежащий к семейству Picornaviridae. Он был определен как энтеровирус 72 типа. В отличие от энтеровирусов, HAV не вызывает цитопатическиих изменений в культурах клеток. Вместо этого он имеет тенденцию вызывать хронические инфекции. Из-за его уникальных особенностей вирус гепатита A признается в настоящее время в качестве прототипа нового рода - Heparnavirusв составе семейства Picornaviridae. Существует только один серотип этого вируса.
Вирус относительно стоек к инактивации температурой в 60 ºC в течение одного часа, эфира и кислоты при pH 3, но инактивируется формальдегидом 1:4 000 при 37 ºC в течение 72 часов. На него не влияют неионные детергенты. Он выдерживает длительное хранение при 4 ºC или более низкой температуре, но разрушается при кипячении в течение одной минуты.
Клинические особенности.Большинство заболеваний протекает бессимптомно. Явная форма заболевания развивается примерно у 5 процентов инфицированных. Инкубационный период - 2-6 недель. Манифестные формы заболевания состоят из двух стадий, продромальной или преджелтушной стадии и желтушной стадии. Начало может быть острое или незаметное с лихорадкой, недомоганием, отсутствием аппетита, тошнотой, рвотой и болезненностью печени. Эти проявления обычно исчезают с началом желтухи. Выздоровление идет медленно, в течение 4-6 недель. В некоторых случаях развивается фатальный молниеносный гепатит. Болезнь протекает менее тяжело у детей, у которых большинство заболеваний является безжелтушным. Летальность невысокая, в пределах от от 0,1 до 1 процента, большинство летальных исходов бывает у взрослых.
Наличие вируса в фекалиях является основным фактором распространения заболевания. Хроническое носительство в кишечнике чрезвычайно редко, и носители, вероятно, не играют существенной эпидемиологической роли. Вирус сохраняется в природе путем последовательной фекально-оральной передачи от человека к человеку. Инфекция легко возникает в условиях недостаточной санитарии и перенаселенности. Было описано несколько вспышек, связанных с выделением вируса пищевиками во время инкубационного периода болезни. Причиной заболевания может быть также употребление в пищу моллюсков, из зараженной воды. Были также зарегистрированы водные вспышки.
Вирус может быть инактивирован адекватным хлорированием воды, но хлорирование не может быть эффективно в присутствии загрязнения органическими веществами.
Кровь пациентов в фазе виремии заразна и очень редко может происходить парентеральная передача инфекции. Однако, нет хронического виремического носительства, поэтому парентеральная передача имеет небольшое эпидемиологическое значение. Трансплацентарная передача вируса не наблюдается. Были зарегистрированы случаи передачи заболевания от шимпанзе к находившимся в контакте с ними людям. Животные, как полагают, получили инфекцию от людей. Нет данных о возможности существования какого-либо естественного неантропогенного источника инфекции.
Эпидемиология гепатита типа A сходна с эпидемиологией полиомиелита. В развивающихся странах инфекция приобретается в детстве и к 10 годам 90 % населения обладает антителами к вирусу. В Индии, гепатит типа A – наиболее частая причина острого гепатита у детей, но значительно реже бывает у взрослых. В развитых странах распространенность заболевания снизилась. В регионах умеренного климата заболевание имеет осенне-зимнюю сезонность, но в тропиках не наблюдается никакой сезонности. В Индии болезнь имеет тенденцию связываться с периодом дождей.
Дата добавления: 2016-02-04; просмотров: 1147;
