Лабораторный диагноз
Этиологический диагноз гепатита типа A возможен путем обнаружения вируса или антител к нему. Вирус может быть выявлен в экстрактах фекалий с помощью ИЭМ в конце инкубационного периода и в преджелтушной стадии, но редко после развития желтухи. Антитела образуются рано. Нарастание титров антител можно выявить в парных сыворотках. IgM антитела появляются в конце инкубационного периода и сохраняются в течение нескольких месяцев. IgG антитела появляются в то же самое время, что и IgM, но сохраняются намного более длительно, возможно пожизненно (Рис. 1).
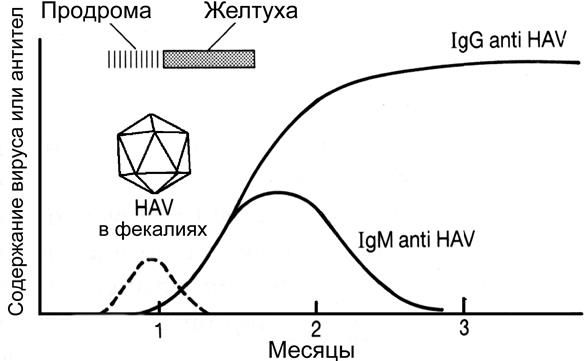
Рис. 1. Типичное течение гепатита А
Поэтому обнаружение IgM антител в сыворотке указывает на свежую инфекцию, в то время как IgG антитела могут означать как свежую, так и отдаленную инфекцию. В настоящее время имеются соответствующие тест-системы для определения антител в ИФА.
Профилактика.Поскольку болезнь передается фекально-оральным путем, общая профилактика состоит в соблюдении санитарных норм и предотвращении фекального загрязнения продовольствия и воды. Эффективна пассивная иммунизация иммуноглобулином человеческим нормальным. Введение иммуноглобулина (16 % раствор в дозе 0.2 - 0.12 мл/ кг веса тела внутримышечно) до инфицирования вирусом или в раннем инкубационном периоде может предотвращать или уменьшать клинические проявления болезни, но не обязательно предотвращает выделение вируса с фекалиями. Одна атака болезни, как полагают, создает иммунитет к гомологичной инфекции, но не к другим типам вирусного гепатита. Применяется также безопасная и эффективная инактивированная формалином адсорбированная на квасцах вакцина против HAV. Она вводится двукратно с интервалом 2 - 4 недели. Вакцина рекомендуется для людей из развитых стран, посещающих страны с высокой распространенностью HAV распространенностью.
Лечениесимптоматическое. Нет никаких доказательств эффективности противовирусных препаратов.
3. ГЕПАТИТ ТИПА В (сывороточный гепатит)
Гепатит В считался своеобразной болезнью, передающейся исключительно парентеральным путем в связи с врачебными манипуляциями типа переливания крови или введения сыворотки и других препаратов крови. Однако, теперь известна возможность передачи также и многими естественными механизмами, с помощью которых между людьми передаются небольшие количества крови или тканевой жидкости.
Клинические особенности.Инкубационный период длительный, 2-6 месяцев, в отличие от более короткого инкубационного периода при гепатите А (2 - 6 недель). Клиническое течение заболевания похоже на гепатит А, но обычно более тяжелое и длительное. Начало незаметное, без повышения температуры. Часты внепеченочные симптомы. Они состоят, главным образом, в высыпаниях, артралгии, нодозоного полиартериита и гломерулонефрита и, как считают, обусловлены действием комплексов антиген-антитело in vivo. У некоторых больных заболевание прогрессирует к хроническому активному гепатиту и циррозу. Поздним последствием HBV инфекции может являться первичная гепатоцеллюлярная карцинома (ГЦК). В геноме опухолевых гепатоцитов обнаруживается интегрированная вирусная ДНК. Были получены перевиваемые линии клеток гепатоцеллюлярной карциномы, продуцирующие поверхностный антиген HBV. Летальность составляет от 0,5 до 2 процентов, но при посттрансфузионном гепатите летальность бывает более высокой.
Эпидемиология.Болезнь распространена повсеместно. Она не имеет сезонности. В развитых странах встречается чаще у взрослых, чем у детей и в городских, чем в сельских районах. Однако, в Африке и на Дальнем Востоке, где заболевание передается от матери потомству или при тесном персональном контакте, оно более часто встречается у новорожденных и детей.
Вирус поддерживается в природе хроническими вирусоносителями с виремией, которых насчитывается более 300 миллионов, приблизительно 35 миллионов из них находятся в Индии. Примерно 5-10 процентов инфицированных людей становятся носителями. Люди, содержащие в крови поверхностный антиген вируса гепатита B в течение более шести месяцев, считаются хроническими, или постоянными носителями. Субклинические инфекции, более вероятно будут приводить к хроническому носительству, чем к острому гепатиту.
Регистрируемая распространенность носителей в различных населенных пунктах варьирует очень широко от 0,1 процентов в развитых странах до 20 процентов в развивающихся странах. Показатель носительства выше в тропических, чем в регионах с умеренным климатом, выше у мужчин, чем у женщин, при инфекциях детского возраста и у иммунодефицитов. Хотя острая и хроническая инфекция может быть воспроизведена экспериментально у шимпанзе, неизвестно наличие естественных резервуаров гепатита В.
Передача - главным образом через кожу. Помимо переливания крови, инфекция может передаваться при многих терапевтических, профилактических и диагностических процедурах. Вирус высоко контагиозен, и заболевание может передаваться очень малым количеством сыворотки носителя (до 0,00001 ml). Поэтому, любая процедура, которая может передавать следы крови или сыворотки от одного человека к другому, может служить распространению инфекции. Татуировка, иглоукалывание, ритуальное обрезание, прокалывание носа и уха, совместное использование бритвы, половой акт и даже поцелуй может передать вирус. Стоматологи и парикмахеры могут заражать своих клиентов. Болезнь особенно часто бывает среди наркоманов, проституток и мужчин-гомосексуалистов.
Было выдвинуто предположение о возможности механической передачи вируса кровососущими насекомыми. В то время как вирус обнаруживается у пойманных москитов и постельных клопов, их роль в передаче инфекции не доказана. Инфекция при приеме пищи предполагается, но требует подтверждения. Экспериментальная инфекция при кормлении возможна, но необходимы относительно большие дозы.
Имеются сообщения о присутствии вируса в различных жидкостях организма и выделениях типа мочи, слюны, молока, спермы, желчи и кала. Существуют данные, позволяющие предположить, что кал не может быть заразным, но некоторые жидкости организма, особенно сперма и слюна, могут передавать вирус. Была зарегистрирована трансплацентарная передача, и врожденная инфекция более широко распространена в тропиках. Предполагается, что перинатальная инфекция происходит главным образом во время родов и что не может быть связана с грудным вскармливаем. Передача инфекции среди членов семьи происходит при совместном пользовании предметами обихода.
Некоторые группы и профессии дают высокий риск развития инфекции. Они включают врачебный и средний медицинский персонал, работников банков крови и пунктов гемодиализа, лабораторных работников, рабочих и штат учреждений для умственно отсталых. Вспышки происходят среди больничного персонала и пациентов.
Вирус гепатита B (HBV)
В 1965 г. Blumberg с сотр. сообщили о белковом антигене в сыворотке австралийского аборигена, который давал четкую линию преципитации с сыворотками двух больных гемофилией, получавших многократные переливания крови. Этот антиген получил название «австралийский антиген». C 1968 г. австралийский антиген ассоциировался с сывороточным гепатитом. Впоследствии он оказался поверхностным компонентом вируса гепатита В (HBsAg).
При исследовании под электронным микроскопом в сыворотках больных гепатитом В обнаруживается три типа частиц (Рис. 2). Наиболее массивная форма - сферическая частица 20 нм в диаметре. Второй тип частицы - трубчатый, разной длины с диаметром 20 нм. Эти два типа частиц антигенно идентичны. Они представляют собой «австралийский антиген», называемый теперь «гепатит-ассоциированный антиген» или «HBs – антиген» и являются поверхностными субъединицами вируса гепатита В, которые продуцируются в большом избытке. Третий тип частиц, которых меньше всего, является структурой с двойной оболочкой диаметром 42 нм. Эта частица - полный вирус гепатита B. Она была сначала описана Дейном в 1970 г. и поэтому известна как «частица Дейна».
Вирион состоит из ядра 27 нм в диаметре с оболочкой толщиной 2 нм и внешней оболочкой или суперкапсидом толщиной 7 нм. Ядро имеет икосаэдральную симметрию. Вирус гепатита B является ДНК-геномным вирусом, содержит частично двухспиральную и частично односпиральную ДНК, а также ДНК-зависимую ДНК-полимеразу. Полимераза восполняет дефект одной нити ДНК при

Рис. 2. Схематическое изображение вируса гепатита В
репродукции вируса. Внутреннее ядро вириона в антигенном отношении отличается от наружной оболочки. Последняя серологически идентична HBs антигену.
Гепатит B вирус классифицируется в составе нового семейства вирусов, названного «Hepadnaviridae», которое включает родственные вирусы гепатита земляной белки, лесного сурка и пекинской утки. Гепаднавирусы могут интегрировать свой геном в ДНК клетки-хозяина, что приводит к персистентной инфекции или злокачественной трансформации.
Для описания различных антигенов и антител, характеризующих вирсуный гепатит типа В, использовались разнообразные названия. Терминология была стандартизирована, и ниже приводятся термины, используемые в настоящее время:
| HBV | Вирус гепатита B. Вирус с двойной оболочкой, 42 нм в диаметре, известный ранее как частица Дейна. | |
| HBsAg | Поверхностный антиген гепатита B. Антиген, находящийся на поверхности вируса, а также в виде свободных сферических и трубчатых частиц 20 нм в поперечнике в сыворотке крови больных гепатитом В. Ранее назывался австралийским антигеном и гепатит -ассоциированным антигеном. | |
| HBcAg | Сердцевинный антиген гепатита B, присутствует в сердцевине вирионов, находящихся в ядрах гепатоцитов, но не поступающих в кровь. | |
| HBeAg | Антиген е гепатита В, связанный с сердцевиной вируса и также с заразительностью крови вирусоносителя. | |
| Anти-HBs | Антитело к HBs - антигену. | |
| Анти-HBc | Антитело к HBc - антигену. | |
| Анти-HBe | Антитело к Hbe - антигену. |
HBsAg обнаруживает антигенное разнообразие. Он состоит по крайней мере из трех различных антигенных компонентов: группоспецифического антигена а и двух пар типоспецифических антигенов типа d-y и w-r, одновременно содержится только один представитель каждой пары. Таким образом, HBsAg может быть разделен на четыре главных антигенных подтипа: adw, adr, ayw и ayr. Описаны также другие антигенные подтипы на основании совокупности перестановок этих субдетерминанат и их вариантов.
Обнаружено различное географическое распределение подтипов HbsAg. Подтип ayw преобладает в широкой географической зоне, простирающейся с Западной Азии через Иран и Пакистан к Индии. Подтип adw преобладает в Европе, Австралии и Америках, в то время как adr распространен на юго-востоке Азии и Дальнем Востоке. Подтип ayr встречается очень редко.
Носители гепатита В.Носители гепатита Вна основаниисерологических маркеров классифицируют на две категории – суперносители и простые носители. Те, у кого в крови содержится HbeAg, находятся на ранних стадиях носительства и являются высококонтагиозными. HBe антиген чаще содержится у молодых, чем у пожилых носителей. Очень малые количества сыворотки или крови таких носителей могут передавать инфекцию. Они имеют высокие титры HBsAg и ДНК –полимеразы в крови и незначительно повышенный уровень трансаминазы в сыворотке. В их крови обнаруживается вирус гепатита В. Их называют суперносителями. В их сыворотке может содержаться примерно десять триллионов частиц в мл, составляя приблизительно 500 микрограммов в мл. Матери-сверхносители очень часто заражают своих новорожденных, и такие дети в свою очередь становятся носителями.
Термин простой носитель применяется к более частому типу носителей, у которых нет HBeAg и низкий уровень HBsAg в крови, HBV и ДНК-полимераза отсутствуют. Простые носители передают инфекцию только при переливании больших объемов крови или сыворотки, например, при гемотрансфузии. Простые носители находятся на более поздних стадиях носительства.
Иммунный ответ.Иммунный ответ при гепатите B развивается на три антигенные системы – HBs-, HBc- и HBe-антигены. И гуморальные и клеточные ответы происходят в течение инфекции.
Антитела к HBsAg связаны с резистентностью к инфекции. Антитела к HBcAg не являются защитными и, очевидно, связаны с количеством и продолжительностью размножения вируса. Наиболее высокие титры анти-HBc обнаруживаются у постоянных носителей HBsAg. Антитела к HBeAg обнаруживаются в сыворотках носителей с низкой контагиозностью.
Гуморальный иммунный ответ во время заболевания не совсем выгоден для хозяина. Он, вероятно, является фактором патогенности, особенно – при молниеносных формах гепатита. Циркуляция иммунных комплексов бывает часто и, как считают, является ответственной за внепеченочные осложнения при заболевании.
Клеточно-опосредованный иммунитет к поверхностному антигену, выявляемый подавлением миграции лейкоцитов, развивается во время острой фазы болезни и исчезает вскоре после выздоровления. Он отсутствует у бессимптомных носителей. Однако, он сохраняется длительно у больных, у которых развивается хронический активный гепатит. Клеточный иммунитет может принимать участие в завершении инфекции и, при некоторых обстоятельствах, способствовать гепатоцеллюлярным поражениям и развитию аутоиммуных поражений печени. Нормальная функция T клеток, как полагают, является предпосылкой для самоограничения течения гепатита, принимая во внимание, что дефектная функция или ее отсутствие может способствовать развитию хронических поражений печени и бессимптомного носительства соответственно.
Лабораторная диагностика.Применяются разнообразные серологические методы для обнаружения антигенов вируса гепатита В и антител к ним, которые служат для диагностики острых и хронических инфекций и вирусоносительства.
HBsAg признан в качестве специфического маркера вирусной инфекции. Он обнаруживается в крови в пределах месяца после заражения за несколько недель до повышения уровня трансаминаз и появления желтухи. Наиболее высокий уровень HBsAg отмечается в преджелтушной фазе болезни. HBsAg исчезает с выздоровлением у большинства больных, но сохраняется в течение многих лет у небольшой части больных. Они являются носителями. Антитела к HBsAg появляются в пределах нескольких недель после исчезновения HBsAg и сохраняются в течение ряда лет. Иммунитет к реинфекции связан с присутствием анти-HBs.
HBeAg не обнаруживается в сыворотке больных, но может быть выявлен в клетках печени методом иммунофлюоресценции.. Антитела к сердцевинному (коровому) антигену обычно появляются в преджелтушной фазе и сохраняются в течение месяцев.
Третья система, связанная с гепатитом B - антиген e и антитела к нему. HBeAg - скрытый антигенный компонент вирусного ядра, вероятно мономерная форма или продукт разрушения HBcAg. Он появляется в сыворотке в то же самое время, что и HBsAg, но в большинстве случаев исчезает через несколько недель. Его исчезновение сопровождается появлением в сыворотке анти-hbeag. Это продолжается в течение нескольких месяцев.HBeAg, как полагают, коррелирует с количеством вирусных частиц и степенью контагиозности носителя. Полагают, что персистенция HbeAg является неблагоприятным прогностическим признаком в отношении тяжести течения болезни. Для обнаружения HbeAg и антител к нему используются методы иммунодиффузии. Вирусная ДНК-полимераза может быть обнаружена случайно во время преджелтушной фазы заболевания. (рис. 3.).
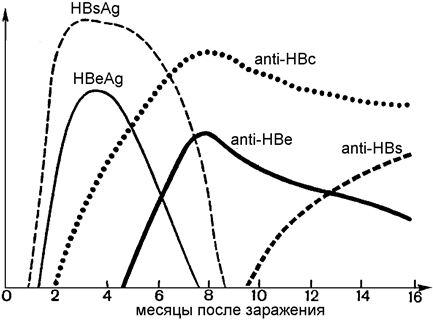
Серологическая экспертиза помогает в определении стадии гепатита B инфекции и ее носительству (Таблица 2).
Таблица 2. Интерпретация серологических тестов при гепатите В
| HBsAg | HBeAg | anti-HBs | anti-HBc | anti-HBe | Интерпретация |
| + | + | — | — | — | Поздний инкубационный период или ранняя стадия гепатита. Высокая контагиозность. |
| + | + | — | + | — | Острый гепатит или суперносительство. Высоко контагиозен.. |
| + | — | — | + | — | Простой носитель, заразен. |
| + | — | — | + | + | Поздняя стадия острого гепатита или носительство с низкой контагиозностью. |
| — | — | + | + | + | Выздоровление в поздней стадии. |
| - | - | + | — | — | Вакцинирован. |
Резистентность вируса гепатита В высокая. При комнатной температуре сохраняет жизнеспособность в течение 3 месяцев, в замороженном состоянии – несколько лет. Вирус полностью инактивируется при автоклавировании (120 ºС), при кипячении в течение 30 минут, сухим жаром при 180 ºС в течение 60 минут, при 60 º - в течение 10 часов. Устойчив в кислой среде, но разрушается в щелочной. Вирус погибает при обработке Н2О2, хлорамином, формалином, фенолом и при УФ-облучении. HbsAg значительно более устойчив к разрушению, чем вирус.
Профилактика
Общие профилактические меры включают санитарное просвещение, улучшение личной гигиены и строгое соблюдение асептики и антисептики. Важная профилактическая мера - обследование доноров на содержание HBsAg, которое теперь является обязательным. Пассивная иммунизация может применяться после любого подозрительного контакта с гепатитом В. Человеческий иммуноглобулин против гепатита В (HBIG), содержащий 200 единиц anti-HBs/мл вводится внутримышечно как можно раньше, и не позже семи дней после контакта в дозе 3 мл для взрослых. Вакцину нужно давать одновременно в виде полного курса иммунизации.HBIG рекомендуется новорожденным от инфицированных матерей. Доза 1-2 мл HBIG вводится вскоре после рождения, не позже чем через 12 часов, с одновременной активной иммунизацией.
Активная иммунизация вначале проводилась с использованием плазмы крови людей-носителей в качестве источника HBsAg, являющегося протективным антигеном. Объединенную плазму носителей инативировали высокой температурой, очищали, концентрировали и обрабатывали формальдегидом 1:4 000. В качестве адьюванта использовались квасцы.
Плазменная вакцина была заменена генно-инженерной вакциной. Метод рекомбинантной ДНК был использован для получения HBsAg в дрожжах (Saccharomyces cerevisiae). Эта вакцина более иммуногенна, чем плазменная вакцина и в настоящее время применяется широко. Полный курс состоит из введения трех доз вакцины внутримышечно в дельтовидную мышцу с интервалом в 1 месяц и 6 месяцев. Обнаруживаемые уровни антител сохраняются по крайней мере пять лет, а защита - в течение намного более длительного периода. Вакцина рекомендуется для всех людей при опасности заражения HBV. Экспериментально испытывались также и другие типы вакцин (гибридная вакцина, антиидиотипическая вакцина и т.д.).
4. ДРУГИЕ ВИРУСЫ ГЕПАТИТОВ
Гепатит D (дельта)
В 1977, Rizzetto и сотр. в Италии идентифицировали новый вирусный антиген в ядрах клетки печени больных, инфицированных вирусом гепатита B. Он был определен как гепатотропный дельта-вирус или вирус гепатита D. Дельта-вирус является дефектным РНК-содержащим вирусом, требующим для своей репликации и экспрессии помощника - HBV. Поэтому он не существует самостоятельно и может жить и размножаться только на фоне персистенции вируса гепатита В в организме хозяина.
HDV - сферической формы частица 36 нм, его внешняя оболочка, состоящая из поверхностного антигена вируса гепатита B, окружает геном из кольцевой односпиральной РНК. Он сходен с некоторыми вирусами растений типа вироидов или с вирусами-сателлитами. Способ передачи – такой же, как и вируса гепатита В. Различают два типа инфекции – коинфекцию и суперинфекцию. При коинфекции заражение дельта-вирусом и HBV происходит совместно и одновременно. При суперинфекции происходит заражение дельта-вирусом человека, уже зараженного HBV. Коинфекция клинически представляет собой острый гепатит B от умеренно выраженного заболевания до молниеносной болезни. Суперинфекция обычно ведет к более тяжелому и хроническому течению болезни с отягощением основной HBV инфекции. Не отмечается связи между HDV и гепатоцеллюлярным раком.
Антиген дельта-вируса прежде всего обнаруживается в ядрах клеток печени, где он может быть выявлен методом иммунофлюоресценции. Он лишь случайно может быть в сыворотке. Антитела против дельта-фактора появляются в сыворотке и могут быть идентифицированы в ИФА. IgM-антитела появляются через 2-3 недели после заражения и вскоре при острой инфекции заменяются IgG-антителами. Однако, при хронической инфекции, IgM антитела сохраняются в течение многих лет. Последовательности РНК дельта-фактора были клонированы и разработаны зонды ДНК для быстрой идентификации дельта-частиц в крови. Подходящей моделью для изучения HDV инфекции оказались североамериканские сурки.
HDV распространен во всем мире, но в некоторых эндемичных регионах встречается чаще. В странах Средиземноморья, в которых он является эндемичным, инфекция обычно передается не инъекционным путем, а при тесном контакте. В неэндемичных регионах, типа Северной Европы и Северной Америки, заражение происходит более часто через кровь и препараты крови и заболевание чаще обнаруживается у наркоманов и больных гемофилией. Привнесение HDV в неэндемичные регионы может вести к вспышкам тяжелого гепатита с высокой летальностью.
Специфической профилактики нет, но иммунизация вакциной HBV эффективна, поскольку HDV не может инфицировать лиц, невосприимчивых к HBV. Обследование доноров на HBsAg автоматически ограничивает заражения HDV через кровь.
ГЕПАТИТ Ни А ни В(NANB)
Общее название ни А ни В гепатит применялось для вирусного гепатита, походившего на гепатит типа А или В, но не вызванного одним из этих двух вирусов. Значение гепатита NANB сначала стало очевидным после того, как даже после обязательной проверки доноров на HBV пострансфузионный гепатит продолжал наблюдаться. Происходили также водные вспышки, похожие на инфекционный гепатит, при которых не было никаких признаков наличия инфекции HAV. Некоторые из вирусов, ответственных за NANB гепатит, были идентифицированы и охарактеризованы, однако больше таких вирусов находится под изучением. В настоящее время алфавит вирусов гепатита нарастает. Кроме типов A, B и D, были признаны важными также вирусы типов C, и E с предложенными, но еще недостаточно охарактеризованными типами F и G.
Гепатит типа С
Значительные достижения в изучении посттрансфузионного гепатита были получены в результате экспериментального заражения шимпанзе. Перекрестные исследования на шимпанзе показали, что имеются по крайней мере два передающихся кровью вируса гепатита NANB, один, чувствительный к хлороформу и образующий характерные эндоплазматические трубочки в инфицированных гепатоцитах, и другой, резистентный к хлороформу и не формирующий трубочек. Первый был идентифицирован как мелкий (30-60 нм) оболочечный вирус с односпиральной РНК, похожий на флавивирус. Он был обозначен как вирус гепатита C (HCV).
В настоящее время HCV - наиболее частая причина посттрансфузионного гепатита в развитых странах. Болезнь клинически и эпидемиологически походит на гепатит типа В.
Инкубационный период - 15-160 дней (в среднем 50 дней). Источником инфекции является человек-носитель. Показатель носительства в развитых странах составляет примерно 1 %. В мире насчитывается примерно 150 миллионов носителей. HCV инфекция наблюдается в Индии и других развивающихся странах, но степень ее распространенности не известна.
Гепатит С наиболее часто отмечается у больных гемофилией, получающих повторные инъекции объединенного фактора VIII, у больных, получающих многократные переливания крови и у наркоманов, практикующих внутривенное введение наркотиков. Вирусемия развивается через 1-2 недели после введения инфицированной крови. Острый гепатит развивается спустя 5-10 недель после заражения, но в большинстве случаев является бессимптомным.
Гепатит С вязан с высоким риском развития хронического гепатита и гепатоцеллюлярного рака. Как и при HBV, инфицирование вирусом гепатита типа С также может происходить независимо от переливания крови. Беспорядочные половые связи, алкоголь или наркотики являются факторами риска при гепатите С. В некоторых тропических регионах ответственной за высокую распространенность гепатита С может быть трансплацентарная вертикальная передача инфекции.
Антиген HCV был клонирован в E.coli. Антитела к рекомбинантному антигену появляются в сыворотке через 1-4 месяцев после заражения и имеют тенденцию к кратковременному сохранению. Обычные серологические исследования обнаруживают только IgG антитела и поэтому не могут обеспечивать раннюю диагностику заболевания. Признаком острого вирусного гепатита может быть выявление антител класса Ig M к сердцевинному антигену вируса гепатита С. Положительные результаты ИФА могут быть также подтверждены методом иммуноблота с рекомбинантным антигеном. Обнаружение РНК вируса гепатита С с помощью полимеразной цепной реакции (ПЦР) обеспечивает точную специфическую диагностику.
По-видимому, существуют различные типы HCV. При лечении некоторый успех достигается применением a-интерферона и рибавирина.

Рис. 4. Иммунологический профиль гепатита С
Гепатит типа E.(Энтерально передающийся NANB или эпидемический NANB гепатит)
Вирусы Гепатита A и B составляют меньше половины случаев острых вирусных гепатитов в большинстве развивающихся стран. Большая часть NANB гепатита в этих регионах передается энтерально через фекальное загрязнение питьевой воды (отсюда название – энтерально передающийся ни А ни В гепатит, или гепатит Е). Он часто проявляется в виде эпидемий (следовательно также называется эпидемический гепатит NANB). Самая большая эпидемия произошла в Дели зимой 1955-56, поразив более чем 30 000 человек в течение шести недель. Разные по величине вспышки и спорадические заболевания наблюдались во многих частях Индийского субконтинента, Центральной и Юго-восточной Азии, Северной Африки и Центральной Америки. Гепатит Е не отмечался в Западных странах кроме случаев завоза из эндемических областей. В Индии, HEV ответствен за большинство эпидемических и спорадических случаев гепатита у взрослых.
Гепатит типа Е раньше принимался за гепатит A из-за их клинического и эпидемиологического подобия. Он был признан в качестве самостоятельной нозологической формы при отсутствии серологических и вирусологических доказательств HAV инфекции. Причина инфекции - фекальное загрязнение питьевой воды и окружающей среды. Вторичное распространение путем бытового контакта при гепатите типа E незначительно, 2-3 процента против 10-20 процентов при гепатите А.
Инкубационный период 2-9 недель, в среднем - шесть недель. Большинство случаев относится к лицам молодого и среднего возраста (15 – 40 лет). Заболевание чаще всего умеренное и самоизлечивающееся, летальность составляет примерно 1 %. Отличительная особенность – тяжелое клиническое течение и высокая летальность (20-40 процентов) у беременных женщин, особенно в последнем триместре беременности.
HEV - сферический безоболочечный вирус, диаметром 32 - 34 нм, с односпиральной РНК. На поверхности вириона обнаруживаются углубления и шипы. Вирус чрезвычайно лабилен. По морфологии и физическим характеристикам он похож на калицивирусы.
HEV можно выявить ИЭМ в желчи и кале больных в инкубационном периоде или острой фазе болезни. Вирусоносительство не наблюдается. Культивирование in vitro пока малоуспешно. Вирусный геном был клонирован. Имеются тест-наборы для IgG и IgM антител в ИФА, использующие рекомбинантные и синтетические пептидные антигены.
Вирус гепатита F
Некоторые люди, получающие кровь и препараты крови, свободные от HBV и HCV заболевают гепатитом. Было предложено назвать предполагаемого возбудителя вирусом гепатита F.
Вирус гепатита G
Название «вирус гепатита G» было предложено для агента, ответственного за синцитиальный гигантоклеточный гепатит. При этом заболевании часты хронический гепатит и печеночная недостаточность. Электронномикроскопические и серологические исследования указывают, что возбудителем может быть парамиксовирус, родственный вирусу кори (таблица 1).
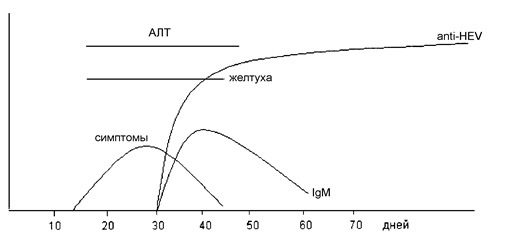
Рис. 5. Иммунологический профиль гепатита Е
5. Онкогенные Вирусы
Впервые вирусы связали со злокачественными новообразованиями в своих наблюдениях Эллерман и Банг (1908), которые отметили, что способ передачи лейкемии у домашней птицы напоминает таковой при инфекционной болезни. Раус (1911) показал, что солидная злокачественная опухоль, куриная саркома вызывается вирусом; за это открытие он был запоздало удостоен Нобелевской премии в 1966. Вирусы, вызывающие опухоли у млекопитающих были впервые обнаружены Шоупом, который выделил вирус фибромы кролика в 1932 и вирус папилломы в 1933. Хотя папиллома является доброкачественной опухолью, она может малигнизироваться. Биттнер (1936) предположил, что рак молочной железы у мышей может быть вызван вирусом, передаваемым от матери потомству через грудное молоко. В течение 1950-ых годов было выявлено большое количество вирусов, вызывающих лейкемию у грызунов. Большой интерес был вызван открытием Стюарт и Эдди (1957) вируса полиомы, который при введении новорожденным грызунам мог вызывать развитие большого количество разнообразных опухолей. Трентином (1962) было показано, что введение некоторых типов аденовирусов человека новорожденным хомякам вызывало развитие сарком. Бёркит (1963) выявил специфическое географическое распространение лимфом у африканских детей и предположил, что они могут быть вызваны вирусом, передающимся насекомыми. Выделенный из лимфомы Бёркита вирус Эпштейна-Барр было предложено считать этиологическим агентом лимфомы Бёркита. Много вирусов было выделено из человеческих опухолей или обнаруживалось электромикроскопически в пораженных клетках и тканях, но большинство из них были только «вирусами-пассажирами». присутствующими в поражениях, а не вызывающими их агентами.
Вирусы, которые вызывают опухоли у своих естественных хозяев или у подопытных животных, или же стимулируют злокачественное преобразование в культуре клеток, известны как онкогенные вирусы. Трансформация представляет собой различные изменения, которые сопровождают преобразование нормальной клетки в злокачественную. Трансформация из нормальных в злокачественные клетки является многостадийным процессом, и может быть частичной или полной. Например, некоторые вирусные агенты могут превращать инфицированные клетки в «неумирающие», так что они становятся способными к непрерывному размножению в культуре, без приобретения других особенностей злокачественного развития.
Таблица 3. ОНКОГЕННЫЕ ВИРУСЫ
| ВИРУСЫ РНК | I. Retroviruses: 1. Вирусы лейкозов птиц 2. Вирусы лекцозов мышей 3. Вирусы рака молочных желез мышей 4. Лейкозно-саркоматозные вирусы различных животных 5. Вирусы Т-клеточной лейкемии человека |
| ВИРУСЫ ДНК | I. Papovaviruses 1. Папилломавирусы человека, кроликов и других животных 2. Полиомавирус 3. Обезьяний вирус 40 4. BK и JC вирусы |
| II. Poxviruses: 1. Вирус контагиозного моллюска 2. Вирус Яба 3. Вирус фибромы Шоупа | |
| III. Аденовирусы Многие типы аденовирусов человека и животных | |
| IV. HERPESVIRUSES 1. Вирус болезни Марека 2. Вирус опухоли лягушек Люке 3. Epstem-Barr вирус 4. Вирусы простого герпеса типов 1 и 2 5. Вирус цитомегалии | |
| V. Вирус гепатита B |
Преобразованные клетки изменены по форме и теряют способность к «контактному торможению» так что вместо роста одним слоем, они растут скоплениями, одна над другой, формируя «микроопухоли». Участки трансформации могут быть легко выявлены и используются при исследовании онкогенных вирусов, таких как вирус саркомы Рауса.
Около четверти из приблизительно 600 вирусов животных обладают онкогеным потенциалом (Таблица 1). Вирусы, связанные с раковыми образованиями людей описаны в Таблице 2. Среди онкогенных вирусов есть и РНК- и ДНК-содержащие. В то время как все онкогенные РНК-содержащие вирусы (которые раньше назывались онкорнавирусы) принадлежат к единственному семейству (Ретровирусы), онкогенные вирусы встречаются среди всех основных групп ДНК-содержащих вирусов, кроме парвовирусов. Ретровирусы ответственны за естественно возникающую лейкемию и саркому у нескольких видов животных. Среди ДНК-содержащих вирусов, некоторые герпесвирусы вызывают злокачественные опухоли у их естественных хозяев.
Ретровирусы.
Ретровирусы - оболочечные, сферические вирусы, которые выходят почкованием через клеточную мембрану хозяина. Они имеют приблизительно 100 нм в диаметре. Геном состоит из двух идентичных линейных односпиральных молекул РНК. Икосаэдральный нуклеокапсид содержит спиральный рибонуклеопротеид и окружен оболочкой состоящей из гликопротеидов и липидов.
Характерная особенность ретровирусов - присутствие в вирионе необычного фермента - РНК зависимой ДНК полимеразы или обратной транскриптазы(отсюда имя retro, означающее обратно). В отличие от классической транскрипции генетической информации от ДНК на РНК, фермент обратная транскриптаза готовит ДНК-копию РНК-генома ретровируса - первоначально РНК-ДНК гибрид, а затем его двухспиральную ДНК-форму. Двухспиральная ДНК-форма ретровирусного генома, называемая провирусом, интегрирует в ДНК инфицированной клетки-хозяина. Именно от провируса транслируются все ретровирусные белки. Заражение онкогенным ретровирусом не ведет к цитолизу или гибели инфицированных клеток, но провирус остается интегрированным в ДНК клетки-хозяина до конца жизни клетки и воспроизводится вместе с клеточным геномом при размножении клеток.
В то время как все онкогенные РНК-содержащие вирусы принадлежат семейству Retroviridae, не все ретровирусы онкогенны. Семейство Retroviridae классифицируется на три подсемейства.
1. Oncovirinaeвключает все онкогенные РНК содержащие вирусы (прежде называемое онкорнавирус).
2. Spumavirinae содержит неонкогенные «пенистые вирусы» (spuma = пена) вызывающие бессимптомные инфекции у нескольких видов животных и представляющие собой загрязняющие примеси первичных культур клеток, в которых они вызывают пенистое перерождение.
3. Lentivirinae включает как вирусы вызывающие «замедленные инфекции» (lentus = медленно) у животных, так и вирусы человеческих и животных иммунодефицитов.
Ретровирусы широко распространены; их находят почти у всех позвоночных, включая животных, птиц и рептилий. Основываясь на круге хозяев и типах вызываемых болезней, онкогенные Ретровирусы можно разделить на следующие группы:
1. Вирусы лейкозно-саркоматозного комплекса птиц. Группа антигенно родственных вирусов, которые вызывают Avian лейкозы (вирусы лимфоматоза, миелобластоза и эритробластоза) или саркому у домашних птиц (вирус саркомы Рауса, ВСР).
2. Вирусы мышиных лейкозов. Эта группа состоит из нескольких штаммов вирусов мышиной лейкемии и вирусов саркомы, названных по имени исследователи впервые описавших их (например Гросс, Френд, Молони, Раушер).
3. Вирус опухоли молочной железы мышей. Этот вирус имеется в некоторых линиях мышей, у которых часто встречается рак молочной железы. Он известен как «молочный фактор» или «вирус Биттнера». Он размножается в молочной железе и передается от матери потомству через грудное молоко. Мыши могут быть заражены через рот, через подкожную или внутрибрюшинную инъекцию. Рак молочной железы развивается только у мышей восприимчивых линий после латентного периода в 6-12 месяцев.
4. Вирусы лейкозов и сарком других животных.Большое количество вирусов было выделено из лейкозов и сарком различных видов животных - кошек, хомяков, крыс, морских свинок и обезьян.
5. Т-лимфотропные вирусы человека (HTLV).Ретровирусы, названные «человеческие Т-лимфотропные вирусы» были выделены в 1980 из культур клеток от взрослых больных кожной T-клеточной лимфомой (грибковый микоз) и лейкемией (синдром Сезара) в США. Подобные вирусы были выделены от больных Т-клеточной лейкемией в Японии и Карибском бассейне. HTLV 1-го типа имеются во всем мире, но распространенность заболеваний ограничена эндемичными областями. Помимо Т-клеточной лейкемии, HTLV-I также связан с тропическим спастическим парапарезом, демиелинирующей болезнью. Вирус в основном инфицирует T4 (CD4) клетки. На инфицированных T-клетках обнаруживается большое количество рецепторов к ИЛ-2. Близко родственные HTLV-II также связаны с T-клеточными злокачественными новообразованиями. Известно, что HTLV-инфекция передается при переливании крови и другими способами введения лейкоцитов.
Видовая специфичность. Ретровирусы обычно поражают только один вид хозяина, специфика обусловлена главным образом присутствием вирусных рецепторов на поверхности клетки-хозяина. В зависимости от их способности расти в клетках другого вида, ретровирусы делятся на 1) экотропные (размножаются только в клетках естественного хозяина); 2) амфитропные (размножаются в клетках естественного и чужих видов); и 3) ксенотропные (размножаются только в клетках чужих видов, но не в клетках естественных хозяев).
Передача вирусов.Возможны два типа передачи ретровирусов. Экзогенные ретровирусы распространяются горизонтально. Большинство онкогенных ретровирусов являются экзогенными. Эндогенные ретровирусы передаются вертикально от родителей потомству провирусом, интегированным в геном половых клеток. Эндогенный ретровирусный провирус ведет себя как клеточный ген и подчинен регулирующему влиянию клетки-хозяина. Эндогенные ретровирусы обычно «молчащие», не трансформируют клетки и не вызывают какое-либо заболевание. Они могут быть обнаружены либо из-за «активации» после воздействия радиации или химикатов, или методом гибридизации нуклеиновой кислоты.
Резистентность. Ретровирусы неустойчивы, инактивируются при 56 оС в течение 30 минут, слабыми кислотами, эфиром и формалином. Они устойчивы при – 30о С
Морфология.Ретровирусы существуют в виде четырех морфологических типов. Частицы типа А существуют только внутри клеток. Они имеют 60-90 нм в диаметре и содержат кольцевидный нуклеоид, окруженный мембраной. Они могут являться формой предшественника других типов. Типы B, C и D являются внеклеточными. Диаметр В частицы – 100-130 nm, с эксцентрическим нуклеоидом и несут поверхностные шипики. Частицы С типа имеют центральный нуклеоид и гладкую поверхностную мембрану. Частицы D типа еще не охарактеризованы. Они имеют эксцентрический нуклеоид и несут короткие поверхностные шипики.
Большинство ретровирусов – частицы С типа. Вирус рака молочных железы мыши - частица типа B, а вирус рака молочной железы обезьян Мэзон-Пфайзера - частица типа D.
Антигены.Имеется два типа антигенов – типоспецифические гликопротеидные антигены, расположенные на оболочке, и группо-специфические нуклеопротеидные антигены, расположенные в ядре вириона. Перекрестные реакции между поверхностными антигенами ретровирусов от различных видов хозяев не наблюдаются.
Геномная структура.Ретровирусы имеют относительно простую геномную структуру.
Провирус стандартного ретровируса (такого как недефектный вирус лейкоза птиц или мышей) состоит из трех генов, требуемых для вирусной репликации - gag, pol, и env. Ген gag кодирует белки нуклеокапсида, которые являются группоспецифическими антигенами, ген polкодирует РНК-зависимую ДНК-полимеразу, ген envкодирует гликопротеиды оболочки. С обоих концов провируса имеется длинный концевой повтор (LTR), непосредственно связывающийся с ДНК клетки-хозяина. LTR-участки обеспечивают контроль регуляции функции генов провируса.
Некоторые ретровирусы (трансрегулирующие вирусы) типа HTLV или HIV несут четвертый ген tat после envгена. Это – трансактивирующий ген, который регулирует функцию вирусных генов.
Стандартные онкогенные ретровирусы типа вирусов хронической лейкемии является медленными трансформирующими вирусами, то есть они имеют низкий онкогенный потенциал и стимулируют злокачественное преобразование вообще только клеток крови после длительного латентного периода. Они не трансформирует культивируемые клетки. Они способны к нормальной репликации. Напротив, острые трансформирующие вирусы - высоко онкогенны и вызывают злокачественное развитие после короткого латентного периода в недели или месяцы. Они могут вызывать различные типы сарком, карцином, лейкозов и также трансформировать клетки в культуре. Однако, наиболее сильные трансформирующие вирусы неспособны нормально реплицироваться, потому что они содержат в своем геноме дополнительный ген, вирусный онкоген (V-oncген) который заменяет некоторых из генов, существенных для репликации вируса. Такие V-onc вирусы могут репродуцироваться только при коинфекции со стандартным помощником ретровируса. Вирус саркомы Рауса, который несет онкоген src (произносится «сарк»), наиболее хорошо изученный среди острых трансформирующих вирусов, отличается способностью реплицироваться, то есть он может нормально реплицироваться, потому что обладает полным комплектом gag, pol, и env генов. Большинство острых трансформирующих вирусов дефектны в отношении репликации.
Дата добавления: 2016-02-04; просмотров: 1435;
