Аналоги нуклеозидов
Дезоксиуридины.Эти аналоги тимидина блокируют тимидинкиназу и эффективны против вируса простого герпеса. Первый из них был 5-йодо-2-дезоксиуридин (идоксуридин, IDU) использовался местно при герпетическом кератите. Родственный 5-трифлуорометил-2-дезоксиуридин (трифлуридин, TFT), более растворимый и менее ядовитый, заменил IDU. Бромвинилдезоксиуридин (BVDU) нетоксичен и даже более активен, особенно против вируса ветряной оспы-опоясывающего герпеса.
Аденинарабинозид (видарибин, ара-А) содержит в аденине вместо рибозы арабинозу. Он использовался местно при герпетическом кератите и парентерально против herpes simplex и инфекций вирусом опоясывающего герпеса-ветряной оспы. Однако для лечения системных инфекций он было заменен ацикловиром.
Ацикловир (ацилгуанозин) - аналог гуанина, активен против вирусов герпеса через тимидинкиназу. Вирусы герпеса, которые кодируют собственную тимидинкиназу (вирус простого герпеса, вирус опоясывающего герпеса-ветряной оспы) гораздо более восприимчивы, чем вирусы, не кодирующие ее (цитомегаловирус, вирус Эпштейна-Барр). Родственный препарат ганцикловир более активен против цитомегаловируса.
Широко известное лекарственное средство азидотимидин (зидовудин, АЗТ), применяемое против ВИЧ-инфекции, - аналог тимидина, который блокирует синтез провирусной ДНК, подавляя вирусную обратную транскриптазу. АЗТ уменьшает заболеваемость и продлевает выживание больных СПИДом, но является токсичным и дорогостоящим.
Синтезирован ряд дидеоксинуклеозидов (дидеоксицитидин, или ДДЦ, дидеоксиинозин или ДДИ, дидеоксиаденозин или ДДА) и обнаружено, что они обладают анти-ВИЧ активностью, блокируя, блокируя обратную транскриптазу.
Рибавирин (виразол) - синтетический нуклеозид, родственный с гуанин-рибозидом. Он проявляет активность против многих ДНК- и РНК-содержащих вирусов. Применяемый в виде аэрозоля, он оказался эффективным при лечении инфекции, вызванной респираторно-синцитиальным вирусом, а также гриппа. Есть сообщения, что внутривенно введенный рибавирин был эффективным против лихорадки Ласса и других геморрагических лихорадок.
2. Другие препараты: Амантадин (адамантанамин гидрохлорид, симметрол) блокирует проникновение в клетку-хозяина вируса гриппа типа А, но не типа В или С., но не B или C. Производное амантадина, ремантадин, менее ядовит и в равной мере эффективен.
Энвироксим и родственные вещества обнаруживают активность против риновирусов.
Фоскарнет (тринатрийфосфатоформиат) специфически подавляет ДНК-полимеразу вируса простого герпеса и обладает также некоторым действием против вируса гепатита B и ВИЧ.
У сурамина, созданного в качестве антипаразитарного средства в 1916 г., была обнаружена способность ингибировать обратную транскриптазу, и он был одним из первых лекарственных средств, используемых при СПИДе. Из-за токсичности и недостаточной эффективности его использование было прекращено.
3. Интерфероны. Открытие интерферонов с активностью против широкого диапазона вирусов дало надежду их применения как антивирусных средств. Однако, большинство испытаний были неудачными. Некоторый положительный эффект был получен при хронических инфекциях типа гепатита B и C, папилломы гортани и при цитомегаловирусной инфекции у реципиентов трансплантата. Высокие дозы интерферона приводят к токсическому действию.
Несмотря на интенсивные усилия, прогресс в области антивирусной химиотерапии недостаточен. Это зависит от многих факторов.
Многие соединения проявляют антивирусную активность в культуре тканей, но большинство из них оказываются неэффективными или токсичными при испытаниях на животных. Пригодные лекарственные средства имеют узкий диапазон активности. Они редко способны полностью освободить организм хозяина от вируса, так что часто развивается рецидив. Вирусы приобретают устойчивость к лекарствам, и беспрепятственное развитие инфекции имеет место иногда даже во время лечения. Состояние антивирусной химиотерапии в настоящее время подобно пресульфаниламидной эре при бактериальных инфекциях. Можно высказать надежду, что лучшее понимание молекулярной и клеточной биологии вирусов и взаимодействия вирусов с организмом хозяина может привести к созданию более эффективной антивирусной химиотерапии.
РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
1. Медична мікробіологія, вірусологія та імунологія : підручник для студ. Вищ. Мед. Навч. заклад. / За редакцією В.П.Широбокова/ Видання 2-е. – Винниця : Нова книга, 2011. – 952 с.
2. Протченко П.З. Загальна мікробіологія, вірусологія та імунологія. Вибрані лекції: Навч. посібник . – Одеса: Одес. Держ. мед. ун-т, 2002. – 298 с.
3. Пяткін К. Д., Кривошеїн Ю.С. Мікробіологія. - К : Высшая школа, 1992. - 432 с.
Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология. - М : Медицина, 1983. - 312 с.
4. Борисов Л.Б., Козьмин-Соколов Б.Н., Фрейдлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии / под ред. Борисова Л.Б. – Г. : Медицина, 1993. – 232 с.
5 Медицинская микробиология, вирусология и иммунология: Учебник под ред. А.А.Воробьева. – М.: Медицинское информационное агентство, 2004. - 691 с.
6. Медицинская микробиология, вирусология, иммунология /ред. Л.Б. Борисов, А.М. Смирнова. - М: Медицина, 1994. - 528 c.
5. Букринская А.Г. Вирусология. – М.:Медицина, 1986. – 336 с.
Лекция 23. РНК-ГЕНОМНЫЕ ВИРУСЫ. ДНК-геномные вирусы
РНК-геномные вирусы
К РНК-содержащим вирусам относят 13 семейств: Reoviridae, Togaviridae, Retroviridae, Bunyaviridae,Flaviviridae, Coronaviridae, Rhabdoviridae, Filoviridae, Paramyxoviridae Orthomyxoviridae, Bunyaviridae, Arenaviridae, Retroviridae, Picornaviridae, Caliciviridae:
Таблица 1. РНК -ГЕНОМНЫЕ ВИРУСЫ
| СЕМЕЙСТВО, Подсемейство | Род | Представители типов |
| REOVIRIDAE | Reovirus Orbivirus Rotavirus | Реовирусы типов I -3 Вирус кемеровской лихорадки, Ротавирусы человека |
| TOGAVIRIDAE | Alphavirus Rubivirus Pestivirus | Вирусы карельской лихорадки, лошадиных энцефаломиелитов Вирус краснухи Вирус чумы животных |
| FLAVIVIRIDAE | Вирусы клещевого, японского энцефалитов денге, желтой лихорадки | |
| CORONAVIRIDAE | Coronavirus | Коронавирус человека |
| RHABDOVIR IDAE | Vesiculovirus Lyssavirus | Вирус везикулярного стоматита Вирус бешенства |
| FILOVIRIDAE | Вирусы Марбург, Эбола | |
| PARAMYXOVIRIDAE | Paramyxovirus Morbillivirus Pneumovirus | Вирусы парагриппа I-5 типов, вирус паротита Вирус кори Респираторно-синцитиальный вирус |
| ORTHOMYXOVIRIDAE | Influenzavirus А, В Influenzavirus С | Вирусы гриппа A, В Вирусы гриппа С |
| BUNYAVIRIDAE | Bunyavirus Nairobivirus и др. | Вирус Буньямвера, Вирус Крымской геморрагической лихорадки |
| ARENAVIRIDAE | Arenavirus | Вирус лимфоцитарного хориоменингита |
| RETROVIRIDAE Oncovirinae Spumavirinae Lentivirinae | Онковирусы В, Онковирусы С, Онковирусы D | Вирус рака молочных желез мышей Вирус саркомы Рауса Вирус Мезон-Пфайзера Пенящийся вирус человека Вирусы висны, ВИЧ- I, ВИЧ-2 |
| PICORNAVIRIDAE | Enterovirus Cardiovirus Rhinovirus Aphtovirus | Вирусы полиомиелита I-3 типов, другие энтеровирусы, вирус гепатта А (энтеровирус 72) Вирус энцефаломиокардита Риновирусы человека Вирус ящура |
| CALICIVIRIDAE | Calicivirus | Калицивирусы человека |
РНК-содержащие вирусы имеют разнообразные структуру и химический состав: от простых, состоящих из нуклеопротеида и 1-2 генов (пикорнавирусы и др.), до сложно устроенных, содержащих десятки генов и имеющих в своем составе различные белки и энзимы (вирусы гриппа, парагриппа и др.). Большой интерес представляет также группа онковирусов (ретравирусы), вызывающих злокачественные новообразования у животных и птиц, потенциальных индукторов лейкоза и рака у человека.
2. ОРТОМИКСОВИРУСЫ
Название «Миксовирусы» - Myxovirus было предложено первоначально для группы оболочечных РНК вирусов, характеризующихся способностью к адсорбции на мукопротеиновых рецепторах эритроцитов,
Таблица 2. Различие в свойствах
ортомиксовирусов и парамиксовирусов
| Свойство | Ортомиксовирусы | Парамиксовирусы |
| Размер вириона | 80-120 нм | 100-300нм |
| Форма | Сферическая, нити в свежем изоляте (выделенном вирусе) | Плеоморфны |
| Геном | Сегментированный, восемь частей РНК | Цельная линейная молекула РНК |
| Диаметр нуклеокапсида | 9 нм | 18 нм |
| Место синтеза рибонуклеопротеида | Ядро | Цитоплазма |
| Генетическая перестройка | Обычна | Отсутствует |
| ДНК-зависимый синтез РНК | Необходим для размножения | Не требуется |
| Эффект актиномицина Д | Подавляет размножение | Не подавляет |
| Антигенная стабильность | Вариабельны | Стабильны |
| Гемолизин | Отсутствует | Имеется |
вызывая гемагглютинцию. Название напоминало сродство вирусов к муцинам (от греч. myxa, означающее слизь). В эту группу были включены вирусы гриппа, свинки (паротита), Ньюкаслской болезни и парагриппа. Последующее обнаружение важных различий между вирусами гриппа и другими вирусами в этой группе привело к их переклассификации на два отдельных семейства: Orthomyxovirdae, состоящего из вирусов гриппа и Paramyxoviridae, состоящего из вируса болезни Ньюкасл, вируса паротита, вирусов парагриппа, кори и респираторно-синцитиального вируса. Таблица 1 перечисляет важнейшие различия между ортомиксовирусами и парамиксовирусами.
ОРТОМИКСОВИРУСЫ
Ортомиксовирусы
Это - большая группа вирусов (приблизительно 20 типов) обладающих сродством к мукопротеинам (отсюда и название, греч.. myxa слизь).
Они вызывают грипп у человека, грипп животных (свиней, лошадей), и грипп и чуму птиц.
Ортомиксовирусы имеют сферическую форму и размеры 80-120 нм. Нуклеокапсид характеризуется спиральной симметрией. Вирионы состоят из нуклеоида в форме спирали нуклеопротеида и внешней липо-углеводо-протеидной мембраны и содержат фермент, который разрушает мукопротеиновые рецепторы клеток восприимчивых людей и животных. Вирионы чувствительны к эфиру и дезксихолату натрия.
Вирусы гриппа
Вирусная этиология гриппа типа А была установлена в 1933 г. У. Смитом, К. Эндрюсом и П. Лэйдлоу. Они установили, что профильтрованные смывы из носоглотки больных гриппом на ранних стадиях болезни были инфекционными. В 1940 г. Т. Френсис и Т. Меджилл открыли вирус гриппа В, а в 1947 г. Р. Тейлор - вирус гриппа С.
Морфология и химический состав. Вирусы гриппа имеют округлую или овальную форму, диаметр 80 -100 нм.
Нуклеокапсид образован рибонуклеопротеидом, покрытым сверху наружной липидно-углеводно-протеиновой оболочкой (суперкапсид).
Белки вируса состоят из семи отличающихся друг от друга полипептидов, четыре из которых связаны с нуклеокапсидом, а три - с наружной оболочкой. Липиды и углеводы взаимосвязаны с вирусными белками, их синтез и специфичность зависят от генома клетки.
Геном вируса представлен однонитчатой РНК, фрагментированной у вирусов гриппа А и В на восемь, вируса гриппа С – на семь фрагментов. Фрагменты в составе вириона слабо связаны между собой.
В составе вириона также присутствует вирусная РНК-зависимая РНК-полимераза: она необходима для инвазионной способности, так как вирионная РНК является минус-нитевой и поэтому должна быть транскрибирована для образования вирусной мессенджер – РНК (мРНК). Вирион окружен оболочкой, содержащей липиды, заимствованные из клеточной мембраны. От вторичной оболочки выступают шипы (рис. 1), которые обеспечивают прикрепление вириона к рецепторам клетки, в результате они способны склеивать эритроциты некоторых видов животных и называются поэтому гемагглютинином (H). Они имеют длину примерно 10 нм и состоят из тримеров идентичных гликопротеидных субъединиц, каждая из которых состоит из двух полипептидных цепей, HA1 и HA2. Эти два полипептида связаны в каждой субъединице одной дисульфидной связью. В вирусной частице молекула гемагглютинина связана с липидной мембраной гидрофобным участком вблизи карбоксильного конца HA2. Вирусы гриппа прикрепляются к клеткам с помощью гемагглютинина, взаимодействующего с мембранными рецепторами, содержащими N-ацетилнейраминовую кислоту (NANA).
Между гемагглютиновыми шипами имеются грибовидные выступы нейраминидазы (N). Головка имеют коробчатую форму и собрана из четырех приблизительно шаровидных субъединиц, присоединенных к стеблю, содержащему гидрофобный регион, встроенный в вирусную оболочку. Фермент катализирует расщепление NANA и прилежащего углеводного остатка в гликопротеине слизи.
Это позволяет вирусу проходить через муцин и избегать действия так называемых «неспецифических» ингибиторов. Нейраминидаза также разрушает гемагглютининовые рецепторы клетки-хозяина. Полагают, что активность нейраминидазы важна на заключительных стадиях выхода новых вирусных частиц из инфицированных клеток.
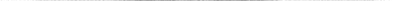
Рис. 1. Схематическое изображение вириона гриппа
NANA всегда присутствует в недавно синтезированных вирионах и ее удаление нейраминидазой предотвращает агглютинацию новых вирусных частиц, что ведет к увеличению числа свободных вирусных частиц и, следовательно, распространению вируса из первоначального очага инфекции.
Вирусы гриппа А и В имеют гемагглютинин и нейраминидазу, вирус гриппа типа С – только гемагглютинин.
Номенклатура
В 1980 Всемирная Организация Здравоохранения (ВОЗ) пересмотрела систему номенклатуры. Она включает ряд существенных параметров: 1) тип вируса; 2) естественный хозяин, если это не человек; 3) географическое происхождение, 4) номер лабораторного штамма 5) год выделения, 6) для вируса типа А затем следует в круглых скобках антигенное описание гемагглютинина и нейраминидазы. Например, вирус гриппа А: Хабаровск / 90 / 77 (H1N1).
Имеется 13 различных H антигенов и десять N антигенов. Только H1-H3 и N1-N2 были пока обнаружены у вирусов человека, остальные выделяются от животных и птиц.
Антигенная структура: антигены вируса гриппа могут классифицироваться на внутренние и поверхностные антигены, внутренний антиген – рибонуклеопотеид и, следовательно, называется РНП–антиген. Так как он обнаруживается в свободном виде в инфицированных тканях и в надосадочной жидкости после центрифугирования вируссодержащей жидкости, он также назывался растворимым (англ. soluble) S-антигеном. S-антиген может выявляться реакцией связывания комплемента и реакцией иммунопреципитации, он является типоспецифическим, и в зависимости от S-антигена вирусы гриппа классифицируются на типы A, B и C. Рибонуклеопротеидные антигены типов А, B и C различаются, но все штаммы каждого типа обладают одинаковым антигеном. S-антиген стабилен и не проявляет существенной антигенной изменчивости. Антитела к этому антигену образуются во время инфекции, но не всегда у лиц, иммунизированных убитыми вакцинами.
Термин «вирусный», «вариабельный» или V-антиген использовался раньше для обозначения поверхностного антигена вируса гриппа. Антитела к V-антигену определяются в реакции связывания комплемента. V антиген фактически состоит, по крайней мере, из двух кодируемых вирусом белков, гемагглютинина и нейраминидазы, эти два белка были выделены и очищены.
Гемагглютинин - гликопротеид, составленный из трех мономеров. Он ответствен за гемагглютинацию и гемадсорбцию и обеспечивает адсорбцию вируса как на мукопротеиновых рецепторах эритроцитов, так и на клетках респираторного эпителия. Антитела-антигемагглютинины образуются после инфекции и иммунизации. Это - защитные антитела, предотвращающие адсорбцию вируса к клеткам. Гемагглютинин - штаммоспецифический антиген и способен к значительной вариации. К настоящему времени идентифицировано 13 различных подтипов гемагглютинина у вирусов гриппа, инфицирующих человека, животных и птиц (их называют H1 - H13).
Нейраминидаза – гликопротеиновый фермент, который разрушает рецепторы клетки в результате гидролиза. Она состоит из четырех мономеров. Антитела к нейраминидазе образуются после инфекции и иммунизации. Они не столь эффективны, как антигемагглютинины. Они не предотвращают адсорбцию вируса на клетках, но могут подавлять выход вирусного потомства и, может таким образом вносить вклад в ограничение инфекции. Нейраминидаза - штаммоспецифический антиген проявляет изменчивость. Пока идентифицировано десять различных подтипов нейраминидазы (N1- N10).
Вирус гриппа обладает общими антигенами с изоантигеном А эритроцитов человека, что и обусловливает неспособность некоторых людей продуцировать против него антитела.
Культивирование. Вирусы гриппа хорошо размножаются в амниотической и аллантоисной оболочках куриных эмбрионов, первично трипсинизированных культурах почек обезьян, эмбриона человека и др.
Резистентность. При комнатной температуре вирус гриппа инактивируется через несколько часов, от нагревания до 65 °С погибает в течение 5- 10 мин. Очень чувствителен к высушиванию, быстро разрушается в кислой, а также щелочной среде, легко обезвреживается под влиянием эфира, дезоксихолата натрия, а также всеми дезинфицирующими веществами: хлорной известью, хлорамином, формалином и др. Губительное действие оказывают на вирус гриппа ультрафиолетовые лучи и ультразвук.
Патогенность для животных. Свиньи, лошади, и некоторые птицы естественно восприимчивы к некоторым типам вируса гриппа. Вирусы типа А и В легко приспосабливаются к многим видам домашних животных во время эпидемий, но их эпидемиологическое значение для человека недостаточно изучено. Из экспериментальных животных наиболее восприимчивыми оказались африканские хорьки. После заражения у них через 2 дня повышается температура, развиваются катары верхних дыхательных путей, отмечаются выделение из носа секрета гнойного характера, чиханье. Мыши и молодые свиньи также восприимчивы к гриппу.
Патогенез заболевания у человека.Входные ворота – респираторный тракт. При экспериментальной инфекции у добровольцев очень малые дозы (приблизительно три жизнеспособных частицы) могут вызывать инфекцию, если попадают аэрозольно. Бóльшие дозы требуются при заражении интраназально. Вирусная нейраминидаза облегчает инфекцию, уменьшая вязкость пленки слизи, выстилающей респираторный тракт и освобождает рецепторы поверхности клетки для адсорбции вируса. Мерцательные клетки дыхательных путей - главные места вирусной инфекции. Эти клетки повреждаются и удаляются, оставляя оголенными базальные клетки в трахее и бронхах. Это делает респираторный тракт высоко уязвимым к бактериальной инвазии.
Вирус гриппа - строго пневмотропен и размножается только в клетках эпителия дыхательных путей. Поскольку вирус размножается и развивается инфекция, постепенно вовлекаются в процесс бронхи, бронхиолы, и альвеолярные эпителиоциты. Поврежденный мерцательный эпителий теряет свои реснички, в результате этого лишается своей защитной функции. Это создает благоприятную среду для проникновения вторичной бактериальной флоры (стрептококков, стафилококков, H. influenzae, микоплазм и др.) которые вызывают осложнения (бронхит, пневмонию, плеврит, энцефалит, гриппозный менингит). Кроме того, грипп активизирует хронические заболевания (туберкулез) и значительно понижает иммунитет к многим инфекциям.
Вирусная пневмония, отмечаемая только в более тяжелых случаях, связана с гиперемией и уплотнением альвеолярных стенок, внутритканевой инфильтрацией лейкоцитами, капиллярным тромбозом и экссудацией лейкоцитов. В некоторых случаях формируется гиалиновая мембрана, заполняющая альвеолярные протоки и альвеолы. В последних стадиях имеется инфильтрация макрофагами, которые озахватывают и удаляют десквамированные альвеолярные клетки.
Болезнь обычно ограничивается респираторным трактом, очень редко во время пандемии 1957 года вирус изолировался из селезенки, печени, почек и других органов.
Клинические особенности. Инкубационный период короткий – 12 - 72 часа. Тяжесть заболевания варьирует от умеренного ринита до молниеносной и быстро заканчивающейся смертью пневмонии, большинство заболеваний протекает субклинически. При типичной клинике начало резкое с лихорадкой, головной болью и общей миалгией. Обычно на первый план выступают дыхательные симптомы и серьезная общая слабость. Могут быть боли в животе и рвота, особенно при гриппе типа В у детей, которые могут давать картину острого живота. Неосложненная болезнь заканчивается через 2 - 7 дней.
Наиболее важное осложнение - пневмония, которая главным образом развивается из-за вторичной бактериальной инфекции или реже, вызвана непосредственно вирусом. Кардиальные осложнения типа застойной недостаточности или миокардита и неврологических поражений типа энцефалита бывают редко.
Иммунитет.Иммунитет к специфическому подтипу вируса, развивающийся после вспышки гриппа, продолжителен. Он обусловлен суммарно местными антителами (IgA) в секретах слизистых дыхательных путей и специфическими IgG антителами в сыворотке. Иммунитет к инфекции, особенно типом А, строго специфичен к сероподтипу и обеспечивает небольшую или вообще не создает невосприимчивости к сероподтипам, обладающим иммунологически отличными белками гемагглютинина или нейраминидазы.
Доказательством стойкости иммунитета при гриппе может служить следующее. В 1977 г. возвратился вирус H1N1 после 20-летнего отсутствия. Эпидемия началась в Китае. Заболевали почти исключительно лица моложе 20 лет, т.е. родившиеся после 1957 г., когда прекратилась циркуляция этого вируса среди населения. Кроме того, иммунитет к вирусу гриппа типа С, который не имеет антигенных вариантов, обычно является пожизненным.
Эпидемиология.Эпидемии, которые были вызваны, вероятно, вирусами гриппа, были описаны уже более 2000 лет назад. Как правило, наблюдается внезапное появление случаев респираторного заболевания; они длятся в течение нескольких недель и затем внезапно прекращаются. Эпидемии происходят часто с неодинаковыми интервалами и, как думали одно время, были под влиянием звезд, отсюда и название – «грипп» (итал. влияние). Хорошо известно, что эпидемии изменяются по тяжести. Большая пандемия 1918-19 г.г. (испанка) была особенно серьезной, она унесла жизнь от 20 до 40 миллионов людей, поскольку она распространялась во всем мире. Именно из-за этого большие усилия были направлены на попытку выяснить причину болезни. Успех пришел в 1933 г., когда Кристофер Эндрю и др. выделили вирус гриппа А.
Длительные исследования по выделению и изучению выделенных вирусов, позволили понять связь между поведением при эпидемии и изменениями вируса. Стало также возможным установить на основании феномена первичного антигенного греха, какие вирусные антигены были распространенны прежде, чем стало возможным выделять вирус. Это означает, что инфекция, вызванная текущим вирусным типом, стимулирует образование антител к ранее циркулировавшим штаммам. Таким образом мы можем установить, какие антигенные компоненты были распространены в конце прошлого столетия путем изучения антител у пожилых лиц.
| 1890 ® | 1900 ® | 1918 ® | 1957 ® | 1968 ® | 1977® | ||||
| H2N2 | H3N8 | H1N1 (испанка) | H2N2 (азиатский грипп) | H3N2 (гонконгский грипп) | H3N2 + H1N1 | H3N2 + H1N1 | |||
Крупные пандемии связаны с антигенным шифтом - когда меняются вирусные H или N, или же оба сразу. Это изменение является слишком большим, чтобы быть результатом мутации, и анализ вирусной РНК указывает, что изменение является результатом приобретения нового полного 4-го и, или 5-го сегмента РНК. В лабораторных условиях легко показать, что, если клетка инфицирована двумя различными штаммами вируса, потомство будет содержать вирус, молекулы РНК которого получены от каждого родителя. Таким образом, «новый» вирус может быть результатом пересортировки, рекомбинации.
Вирусы гриппа А могут быть выделены от птиц, включая морских птиц и уток, и это наводит на мысль что, если такой вирус ко-инфицирует (то есть совместно заражает) клетку с циркулирующим человеческим штаммом, гибридизация может приводить к тому, что вирус гриппа человека приобретает новые оболочечные антигены.
Данные о том, что антигенные варианты, вызывавшие инфекцию в прошлом, были обнаружены у человека или других видов животных, дают возможность сделать вывод о существовании ограниченного числа антигенов. До 1977 это было правилом, что, когда появлялся «новый» вирус, «старый» исчезал. но начиная с этого времени циркулировали одновременно два подтипа, а именно H3N2 и H1N1. Последний антигенный вариант не обнаруживался начиная с 1950-го года.
У вирусов гриппа B не обнаруживается антигенного шифта, как нет и резервуара среди животных и, хотя эпидемии происходят с интервалом в 3-6 лет, они никогда не достигают размеров пандемии, и их распространение обычно ограничивается небольшими коллективами типа школ - интернатов или домов престарелых. Антигенные изменения являются результатом мутации, также, как и обнаруживаемые у вируса гриппа А после появления «новых» вирусных штаммов, изменения обусловлены дрейфом антигенов.
Периодичность вспышек гриппа характерна, но увеличение распространенности всех респираторных вирусных инфекций осенью и зимой в странах с умеренным климатом может маскировать эпидемиологическую картину гриппа. Заболеваемость гриппом может достигать 20-40%, и распространение вспышки может быть быстрым. Вероятно, вдыхание холодного воздуха зимой может снижать активность мерцательного эпителия в верхних дыхательных путях и таким образом увеличивать заболеваемость респираторными инфекциями. Массовое скопление людей, например в новогодних компаниях, может облегчать распространение вируса. Кроме того, по некоторым данным, количество клеточных рецепторов к вирусу может быть различной в зависимости от сезона.
ВОЗ контролирует грипп А и B во всем мире, чтобы обнаружить появление вариантов. Таким образом, можно проследить распространение подтипа варианта в мире, обычно с востока на запад. Тяжесть и распространение можно установить путем расчета показателей смертности.
Пиковые количество случаев отмечается с появлением нового штамма. Это связано с появлением с интервалом в год-два вируса, который антигенно «дрейфовал» от материнского типа. Далее дрейф может приводить к последующим эпидемиям разной степени.
Высокие показатели заболеваемости отмечаются у дошкольников, заболеваемость ниже даже у пожилых. Однако, пожилые пациенты в домах престарелых, если они не иммунизированы, являются группой особого риска тяжелого заболевания и внезапной смерти. Таким образом, даже если показатель заболеваемости и низкий, коэффициент смертности высок. Инфекция может быть занесена персоналом, посетителями или другими пациентами.
Вирус гриппа типа C не ассоциируется с эпидемиями, но дает повышение заболеваемости острыми респираторными инфекциями, особенно у детей. Большинство инфекций являются бессимптомными.
Лабораторная диагностика. Основана на вирусологическом и серологическом методах исследования. Вирусологический метод используется с целью выделения вируса и его идентификации. Носоглоточными смывами, к которым для подавления бактериальной микрофлоры добавляют антибиотики или подвергают ультрацентрифугированию, заражают 9—11-дневные куриные эмбрионы или клеточные культуры. После 3—4 сут культивирования вирус гриппа обнаруживают с помощью реакции гемагглютннации в аллантоисной и амниотической жидкостях куриного эмбриона, а в тканевых культурах—реакцией гемадсорбпии.
Идентификация вируса проводится с помощью реакций торможения гемагглютинадии и нейтрализации вируса с использованием специфических иммуявых-сывороток.
Серологическая диагностика предусматривает обнаружение нарастания титра специфических антител в сыворотках больных в динамике заболевания при помощи реакций торможения гемагглютинации, связывания комплемента и нейтрализации вируса. Для постановки этих реакций кровь берут в первые дни болезни и-в период выздоровления. У переболевших гриппом людей титр антител увеличивается в 4 раза и более.
Кроме описанных методов, для диагностики гриппа используют экспресс-метод, основанный на применении прямой и непрямой иммунофлюоресценции. Для этого готовят мазки-отпечатки из отделяемого верхних дыхательных путей (носоглотки), в котором находятся клетки цилиндрического эпителия, и обрабатывают их типоспецифическимн сыворотками, меченными флюорохромами. При просмотре мазков в люминесцентном микроскопе при наличии вируса гриппа в клетках цилиндрического эпителия обнаруживается зеленовато-желтое свечение.
Лечение. Применяют комплексную терапию, направленную на подавление репродукции вируса гриппа в организме и нейтрализацию токсинов. Хороший результат получен при введении в первые дни болезни противогриппозного донорского иммуноглобулииа, сухой противогриппозной сыворотки, лейкоцитарного интерферона, а также химического препарата ремантадина. Предупреждение осложнений достигается использованием антибиотиков в сочетании с сульфаниламидами.
Профилактика. Грипп передается воздушно-капельным путем. Источник инфекции – больной гриппом, который может инфицировать здоровых людей при чихании, кашле, и разговоре.
Предупреждение гриппа осуществляется путем изоляции больных, систематического проветривания помещений и уборки их влажным способом (раствором хлорамина), закаливания организма, занятия физкультурой и спортом, предотвращения сквозняков в жилых и рабочих помещениях.
Вакцинация. Гриппозные вакцины использовались в течение многих десятилетий. Первоначально вакцины состояли из вируса, который выращивали в аллантоисной полости куриных эмбрионов, частично очищенного и инактивированного формалином. Из-за присутствия яичного белка, эта вакцина может вызывать реакции у больных с аллергозами. Цельная вирусная вакцина вызывает лихорадку и местную болезненность. Субъединичные вакцины были предложены, чтобы уменьшить токсические реакции. Очищенный вирус разрушают обработкой эфиром или дезоксихолатом так, чтобы вакцина содержала иммуногенные субъединицы гемагглютинина и нейраминидазы.
Главная трудность в иммунопрофилактике гриппа - частые изменения антигенных составляющих вируса. Вакцины не могут быть произведены в больших количествах и про запас, поскольку появление нового варианта будет делать старую вакцину устаревшей В странах холодного климата, где необходимо обеспечить защиту старым людям и лицам других групп высокого риска, на практике необходимо иммунизировать их вакциной, содержащей самые последние штаммы вирусов типа A и B.
Наиболее важное показание для иммунопрофилактики - то, когда новый вирус угрожает пандемией. Здесь, время, необходимое для изготовления вакцины с новым вариантом критическое, поскольку вирус, вероятно, распространится быстро и инфицирует целые населенные пункты прежде, чем вакцина становится доступной. Кроме того, наиболее свежие изоляты (выделенные вирусы), не растут хорошо в куриных эмбрионах, пока они не прошли последовательное пассирование. Чтобы преодолеть эти препятствия, была предложена рекомбинантная вакцина. Рекомбинант обладает особенностями роста старых стабилизированных штаммов и несет поверхностные антигены нового варианта. Рекомбинант будет расти хорошо в куриных эмбрионах, что облегчает производство вакцины.
В то время как убитые вакцины стимулируют формирование циркулирующих антител, они не приводят к какой-либо местной защите в дыхательных путях.
Для создания специфического местного иммунитета использовались живые вакцины. Самая ранняя живая вакцина готовилась из вируса, аттенуированного последовательными пассажами на куриных эмбрионах. Она применялась интаназально. Однако, она иногда вызывала заболевание, особенно у детей.
Другой подход к получению живых вакцин - использование чувствительных к температуре мутантов. Могут быть легко выделены мутанты, которые способны развиваться при более низкой температуре слизистой оболочки носоглотки (при 32 -34 °C) но не в легких при 37 " C. Такие ts- мутанты авирулентны. Рекомбинантые живые вакцины могут быть получены путем гибридизации между ts-мутантами стабилизированных штаммов и новым антигенным вариантом.
Эффективна химиопрофилактика ремантадином, который подавляет адсорбцию вируса гриппа типа А к клеткам. Применяют также интерферон и противогриппозный иммуноглобулин.
Лабораторный диагноз.
1. Обнаружение вирусного антигена. Быстрый диагноз гриппа может установлен путем обнаружения вирусного антигена на поверхности клеток носоглотки методом иммунофлюоресценции. Из мазков, взятых тампоном из носа и отделяемого носоглотки или осадка после центрифугирования носоглоточных смывов готовят мазки-препараты, обрабатывают люминесцирующей сывороткой против вируса гриппа и исследуют под люминесцентным микроскопом. Обнаруживаются клетки, флюоресцирующие из-за присутствия на их поверхности вирусных антигенов. Этот метод не является ни столь же надежным, ни столь же чувствительным, как выделение вируса.
2. Выделение вируса. Выделить вирус достаточно легко от больных в течение первых двух или трех дней болезни, но обычно не в более поздних стадиях. Носоглоточные смывы собирают, используя подходящий солевой буферный раствор. Если материал не может быть обработан немедленно, его нужно хранить при 4 ºС , или, если срок задержки большой, при – 70 ºC. Исследуемый материал нужно обработать антибиотиками, чтобы уничтожить бактерии. Выделять вирус можно на куриных эмбрионах или в культуре клеток почек обезьяны.
Материал вводят в амниотическую полость 11-13 дневных куриных эмбрионов, используя по крайней мере шесть эмбрионов для каждого исследования. После инкубации в 35 ºC в течение трех дней, эмбрионы охлаждают и собирают раздельно амниотическую и аллантоисную жидкости. Их испытывают в реакции гемагглютинации, используя параллельно эритроциты морской свинки и куриные эритроциты при комнатной температуре и при 4 ºС. Некоторые свежевыделенные штаммы вируса гриппа типа A склеивают только эритроциты морской свинки. Вирусы типа В агглютинируют оба вида эритроцитов, в то время как штаммы вируса типа С склеивают только куриные эритроциты при 4 ºС.
Если нет гемагглютинации, проводят «слепой» пассаж гомогенатов легких и печени эмбриона через другую партию эмбрионов, что иногда приводит к восстановлению вируса. Изоляты идентифицируют и типируют в реакцией связывания комплемента с антисыворотками к типам A, B и C. Идентификация сероподтипа проводится в реакции торможения гемагглютинации (РТГА). Часть современных штаммов типа A может быть выделена при первичном введении клинического материала в полость аллантоиса 9-11 –суточных куриных эмбрионов. Однако, вирусы типов B, и C не будут обнаружены, если применяется только заражение в полость аллантоиса.
Заражение культур клеток почек обезьяны или других пригодных перевиваемых культур клеток почти столь же эффективно, как и заражение куриных эмбрионов для выделения вируса типа А и немного более чувствительно для штаммов типа В. Размножение вируса может быть обнаружено при исследовании культуральной жидкости в реакции гемагглютинации и гемадсорбции. Быстрые результаты могут быть получены при выявлении вирусного антигена в зараженных клетках в реакции иммунофлюоресценции.
3. Серологическая диагностика.
Для серологической диагностики гриппа используются реакция связывания комплемента и реакция торможения гемагглютинции. Существенно исследовать парные сыворотки, выявляя нарастание титра антител. Реакции связывания комплемента с РНП антигеном типов вируса гриппа A, B и C очень полезны, поскольку антитела образуются при инфекции, но не после иммунизации инактивированными вакцинами. Реакция связывания комплемента может также быть поставлена с использованием V - антигенов для выявления штаммоспецифических антител. Из-за своей сложности, РСК используется теперь редко.
Реакция торможения гемагглютинации - удобноая и чувствительная реакция для серологического диагноза гриппа. Однако, она имеет некоторые недостатки. Поскольку антитела-антигемагглютинины являются специфичными к сероподтипу, необходимо использовать в качестве антигена-диагностикума штамм, вызвавший инфекцию в настоящее время.
Главное препятствие - частое присутствие в сыворотке неспецифических ингибиторов гемагглютинации. Сыворотки, соответственно обработанные для удаления неспецифических ингибиторов, разбавляются последовательно в лунках плексигласовых планшетов для гемагглютинации и в каждую лунку добавляют суспензию вируса гриппа, содержащую 4 ГАЕ (гемагглютинирующих единиц). Затем добавляют куриные эритроциты. Наибольшее разведение сыворотки, которое подавляет гемагглютинацию является титром сыворотки.
Антитела к нейраминидазе можно определить в реакции нейтрализации нейраминидазной ферментативной активности. Однако, они слишком трудоемки для обычного использования.
Реакция радиальной иммунодиффузии агарозном геле была описана для идентификации антител к РНП антигену, гемагглютинину и нейраминидазе. Однако, они более полезны как тесты для выявления скрытой формы заболевания чем для обычного диагноза.
ПАРАМИКСОВИРУСЫ
В семейство Paramyxoviridae включены три рода – Paramyxovirus, Morbilivirus и Pneumovirus, содержащих патогенные для человека вирусы.
Вирусы имеют сферическую форму, диаметр 100 - 300 нм. Нуклеокапсид окружен липидно-углеводно-протеиновой оболочкой. Обладают гемагглютинирующей, гемолитической и нейраминидазной активностью, способностью образовывать синцитий в клеточных культурах и эозинофильные цитоплазматические включения; в антигенном отношении характеризуется многообразием. У людей парамиксовирусы вызывают парагрипп, эпидемический паротит, корь и РС-инфекцию.
Дата добавления: 2016-02-04; просмотров: 1584;
