Полярность молекул.
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны. Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы. Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2). При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
| Hδ+ → Clδ− | Bδ+ → Fδ− |
| Cδ− ← Hδ+ | Nδ− ← Hδ+ |
(здесь δ - частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.В симметричных по форме молекулах (например, BF3) "центры тяжести" отрицательного (δ−) и положительного (δ+) зарядов совпадают, а в несимметричных молекулах (например, NH3) - не совпадают. Вследствие этого в несимметричных молекулах образуется электрический диполь - разнесённые на некоторое расстояние в пространстве разноименные заряды, например, в молекуле воды.
Химическую связь с помощью общих электронных пар называется ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, он - неполярный, а если смещены в сторону более электроотрицательного атома - полярный.
Принципиально возможны два механизма образования ковалентной связи:
1. спаривание электронов двух атомов при условии противоположной ориентации их спинов;
2. донорно-акцепторное взаимодействие, при котором общей становится готовая электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Повторим образования ковалентной и ионной связей на примере соединений химических элементов с порядковыми номерами 1, 8, 11, 17.
Сначала запишем электронные и графические электронные формулы атомов указанных элементов:
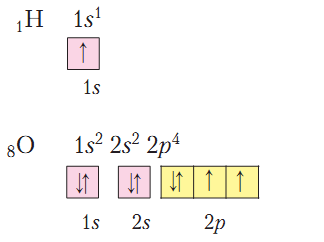
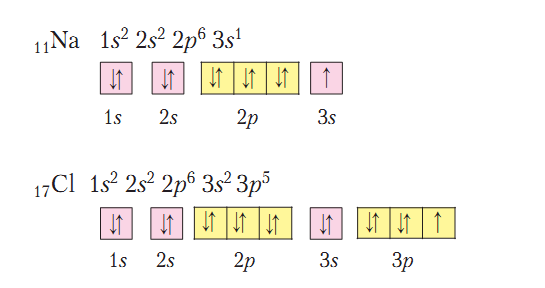
Имеющийся в атоме Водорода 1 электрон составляет половину от количества, завершенного для него (двухэлектронного) внешнего энергетического уровня. У Кислорода на внешнем энергетическом уровне 6 электронов, то есть он близок к завершенному для него восьмиэлектронному составу. Имея половину и более половины электронов, чем их есть на завершенном энергетическом уровне, атомам этих элементов энергетически выгоднее не отдавать электроны, а присоединять или образовывать общие электронные пары. Так, в молекуле водорода два атома Водорода достигают завершенности внешнего энергетического уровня за счет образования общей электронной пары, в молекуле кислорода - двух (рис. 2).
·електронегативність
ім
1.1
электроотрицательность
Додатково…
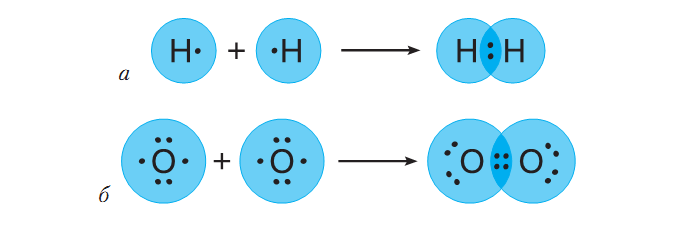
Рис.2. Схемы образования химической связи между атомами одного
химического элемента Водорода (а); Кислорода (б).
В обеих молекулах общие электронные пары равноудалены от ядер атомов, между которыми образовалась химическая связь. Химическая связь с помощью общих электронных пар называется ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, он - неполярный, а если смещены в сторону более электроотрицательного атома - полярный.
Натрий хлорид, в отличие от водорода, кислорода и воды, является веществом немолекулярного строения. Поэтому образование химической связи происходит по-другому. Атом Натрия отдает единственный электрон внешнего энергетического уровня и превращается в катион, у которого завершенный внешний энергетический уровень (им становится предпоследний энергетический уровень атома Натрия). Потому Хлору энергетически выгодно присоединить этот электрон на внешний энергетический уровень и завершить его. При этом нейтральные атомы Натрия и Хлора превращаются в заряженные частицы - ионы:
- електронегативність
ім
1.1
электроотрицательность
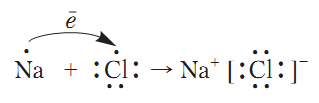
Связь, которая образуется в веществах за счет притяжения разноименно заряженных ионов, называется йонной связью.
Ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов.
Дата добавления: 2016-01-26; просмотров: 3049;
