Реакции, идущие без изменения состава веществ.
Реакция, идущая без изменения состава вещества - в неорганической химии примерами таких химических реакций являются процессы изменения аллотропных модификаций одного и того же химического элемента (графит переходит в алмаз, кислород в озон).
В органической химии примерами будут реакции изомеризации алканов, алкенов, алкинов и другие, идущие без изменения не только качественного, но и количественного состава реагентов.
Аллотропия- существование двух и более простых веществодного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Причиной аллотропии являются, например, разное число атомов в молекуле, как у кислорода О2 и озона О3.Или разное строение кристаллической решетки, как у алмаза и графита. И у того и другого она атомная, но упаковка в них атомов углерода определяется его гибридизацией. Ни один элемент Периодической системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных, которое присуще углероду. В карбине и фуллерене, между атомами углерода существуют двойные и тройные связи. Все это сказывается на физических и химических свойствах аллотропов. Графит, алмаз, карбин, лонсдейлит, фуллерены, углеродные нанотрубки, графен, аморфный углерод- все это аллотропия углерода, а у кислорода сам кислород и озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден. Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо. В природе озон образуется не только при электрических разрядах в атмосфере, но и под действием ультрафиолетового излучения Солнца.
Известно 11 аллотропных модификацийфосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. Белый фосфор похож на воск, он мягкий и легкоплавкий, светится в темноте и вдобавок огнеопасен и ядовит. Чтобы избежать самовоспламенения белого фосфора, его хранят под слоем воды. Если нагревать белый фосфор до 300°С без доступа воздуха, он превратится в красный фосфор. Красный фосфор - порошок красно-фиолетового цвета, не ядовитый и совсем не светящийся. Под очень большим давлением получается чёрный фосфор, похожий по свойствам на металл.
У серы большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Реакции, идущие с изменением состава веществ. Классификация:
а.Реакции соединения:
Из нескольких веществ образуется одно сложное вещество (сопровождаются выделением тепла, всегда носят окислительно-восстановительный характер).
A + B + C = D
S + O2 = SO2
СаСО3 + СО2 + Н2О = Са (НСО3)2,
2FеСl2 + Сl2 = 2FеСl3.
б.Реакции разложения:
Из одного сложного вещества образуется несколько новых веществ.
А = В + С + D.
2KNO3 → 2KNO2 + O2↑
CH4 → C + 2H2
Из реакций разложения следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
CuSO4 5H2O=CuSO4 + 5H2O
Cu(OH)2=CuO + H2O
H2SiO3=SiO2 + H2O.
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
2SO3=2SO2 + O2.
4HNO3=2H2O + 4NO2O + O2O.
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты. Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования:
C4H10 = C4H6 + 2H2.
в. Реакции замещения.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2 = СН3Сl + НСl.
г. Реакции обмена.
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН) 3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са (НСО3)2 + Са (ОН) 2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
По тепловому эффекту:
-Реакции, протекающие с выделением тепла, называются экзотермическими реакциями.
С + О2 → СО2 + Q
-Реакции, протекающие с поглощением тепла, называются эндотермическими реакциями.
N2 + O2 → 2NO – Q
По признаку обратимости:
-Обратимые – реакции, проходящие при одних и тех условиях в двух взаимопротивоположных направлениях.
H2 + I2 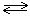 2HI
2HI
-Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми, при этом должен выделяться газ, осадок, или малодиссоциирующее вещество- вода.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 +2HCl → 2NaCl + CO2↑ + H2O
Окислительно-восстановительные реакции – реакции, протекающие с изменением степени окисления.
Са + 4HNO3 → Ca(NO3)2 + 2NO2 + 2H2O
И реакции, протекающие без изменения степени окисления.
HNO3 + KOH → KNO3 + H2O
Различают два процесса: Окисление – это отдача электронов, в результате степень окисления увеличивается. Атом молекула или ион, отдающий электрон называется восстановителем.
Mg0 - 2e → Mg+2
2I- 2e → I2
Восстановление –процесс присоединения электронов, в результате степень окисления уменьшается. Атом молекула или ион, присоединяющий электрон называется окислителем. S0 +2e → S-2
O20 +4e → 2O-2
В окислительно–восстановительных реакциях должно соблюдаться правило электронного баланса(число присоединенных электронов должно быть равно числу отданных, свободных электронов быть не должно). А так же должен соблюдаться атомный баланс(число одноименных атомов в левой части должно быть равно числу атомов в правой части).
Контроль знаний:
Дата добавления: 2016-01-26; просмотров: 23216;
