Общая характеристика неметаллических элементов. Неметаллы как простые вещества.
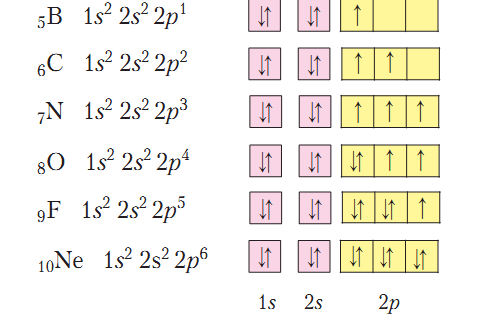
Неметаллические элементы Бор, Карбон, Азот, Кислород, Фтора и Неона относятся ко второму периоду периодической системы химических элементов и имеют такие электронные и графические электронные формулы атомов:
По этим формулам четко прослеживается одинаковое строение первого энергетического уровня неметаллических элементов второго периода и постепенное увеличение числа электронов на втором (внешнем) энергетическом уровне, пока последний элемент Неон не достигнет завершенности внешнего энергетического уровня. Начиная с Азота, в атомах химических элементах наблюдается постепенное уменьшение количества неспаренных электронов на внешнем энергетическом уровне. Так, атом Азота способен образовать три общие электронные пары с другими атомами, Кислорода - две, Фтора - одну.
В атоме Неона отсутствуют неспаренные электроны, и он не образует химических связей с другими атомами.
Рассмотренные примеры доказывают, что атомы неметаллических элементов второго периода имеют по 2 энергетических уровня, но отличаются количеством электронов на внешнем энергетическом уровне.
Особенностью атомов неметаллических элементов является то, что количество электронов на внешнем энергетическом уровне совпадает с номером группы.
Поэтому без записи электронной формулы атома, например, неметаллического элемента VII группы Астату можно с уверенностью сказать, что с 85 электронов в его электронные оболочки 7 находятся на внешнем энергетическом уровне. Неметаллические элементы одной подгруппы. Карбон и Кремний находятся в IV группе главной подгруппе периодической системы химических элементов, т.е. являются элементами одной группы и подгруппы.
Напишем электронную и графическую электронную формулу атома Кремния:
·електронегативність
ім
1.1
электроотрицательность
До
·електронегативність
ім
1.1
электроотрицательность
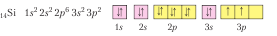
Воспользуемся электронной и графической электронной формулой атома Углерода из примера 1 и сравним электронные формулы атомов этих химических элементов. Результаты сравнения указывают на то, что электронные оболочки их атомов отличаются числом энергетических уровней, однако на внешнем энергетическом уровне у них одинаковое количество электронов и она численно равна номеру группы. Электронные формулы атомов Углерода и Кремния свидетельствуют, что неметаллические элементы IV группы главной подгруппы имеют одинаковое строение внешнего энергетического уровня и количество электронов в нем равна половине электронов внешнего завершенного восьми электронного энергетического уровня.
Задачи: 1. Напишите электронные и графические электронные формулы неметаллических элементов третьего периода и сделайте вывод, что общего и чем отличается строение электронных оболочек их атомов.
2.Напишите электронные и графические электронные формулы неметаллических элементов V группы главной подгруппы Азота и Фосфора.
Общая электронная формула атомов неметаллов ns2np1−5, этому соответствует большое разнообразие степеней окисления неметаллов в соединениях.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению высокой окислительной активности. Вот почему значения электроотрицательности у них велики. Отсюда многообразие в химических свойствах и способах получения неметаллов.Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Другая характерная особенность неметаллов - стремление образовывать ковалентные связи с атомами других неметаллов и амфотерных элементов. Поэтому и простые вещества и соединения неметаллов имеют ковалентное строение. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств.
Неметаллы имеют различное агрегатное состояние при обычных условиях:
- газы – H2, O2, O3, N2, F2, Cl2;
- жидкость – Br2;
- твердые вещества – модификации серы, фосфора, кремния, углерода и др.( I2, At, , Te, As, и В).
Молекулы неметаллов могут состоять из разного количества атомов.
Физические свойства неметаллов.
Неметаллы отличаются по цвету, запаху, отсутствуют блеск. Агрегатное состояние: жидкое, твердое, газообразное. Теплопроводность (только графит). Электропроводность. (только графит и черный фофсфор). Так, водород, кислород, азот - бесцветные газы; фтор - бледно-желтый, а хлор - желто-зеленый ядовитый газ с резким специфическим запахом; бром - темно-красная жидкость, желто - бурые пары которой имеют резкий, раздражающий запах, а при попадании на кожу вызывают сильные ожоги.
Сера- твердое вещество желтого цвета. Йод - твердое черно-фиолетовое вещество с металлическим блеском.
Поскольку неметаллы имеют разные агрегатные состояния, то и температуры их плавления и кипения находятся в широких пределах. Газообразные неметаллы (водород, кислород, азот) при нормальных условиях кипят при низких температурах (около -200 °С). Твердое вещество йод при нагревании сублимируется - сразу переходит из твердого состояния в газообразное. Для того чтобы расплавить серу, достаточно температуры спиртовки или сухого горючего, тогда как одна из аллотропных видоизменений Углерода - алмаз - имеет температуру плавления свыше +3000 °С.
Большинство неметаллов не проводят электрический ток, т.е. являются диэлектриками. Кремний - полупроводник, а графит - проводник электрического тока. Неметаллы плохо проводят тепло, хрупкие, растворимость в воде не является их характерной общим свойством. Однако многие из них хорошо растворимы в органических растворителях. Лучшую растворимость в воде имеют галогены. Раствор брома в воде известный вам под названием бромная вода.
Дата добавления: 2016-01-26; просмотров: 9148;
