Особые свойства азотной и концентрированной серной кислоты.
Азотная кислота - HNO3, кислородосодержащая одноосновная сильная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентраций 68,4 % и tкип120 °C при 1 атм. Известны два твёрдых гидрата: моногидрат (HNO3•H2O) и тригидрат (HNO3•3H2O).
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
HNO3 ---> 4NO2 + O2 + 2H2O
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении.
Азотная кислота является сильным окислителем, концентрированная азотная кислота окисляет серу до серной, а фосфор — до фосфорной кислоты, некоторые органические соединения (например, амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО 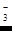 может восстанавливаться до различных продуктов:
может восстанавливаться до различных продуктов:

Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO 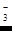 , тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется
, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется 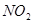 .
.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных металлов — железа, цинка, — образуется 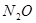 .
.
Сильно разбавленная азотная кислота взаимодействует с активными металлами -цинком, магнием, алюминием -— с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. Так, концентрированная азотная кислота реагирует с медью с образованием диоксида азота, а разбавленная — оксида азота (II):
Cu + 4HNO3----> Cu(NO3)2 + NO2 + 2H2O
3Cu + 8 HNO3 ----> 3Cu(NO3)2 + 2NO + 4H2O
Большинство металлов реагируют с азотной кислотой с выделением оксидов азота в различных степенях окисления или их смесей, разбавленная азотная кислота при реакции с активными металлами может реагировать с выделением водорода и восстановлением нитрат-иона до аммиака.
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислотой и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе и золото. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
3HCl + HNO3 ----> NOCl + 2[Cl] =2H2O
Серная кислота – тяжелая маслянистая жидкость, не имеющая цвета. Смешивается с водой в любых отношениях.
Концентрированная серная кислота активно поглощает воду из воздуха, отнимает её от других веществ. При попадании органических веществ в концентрированную серную кислоту происходит их обугливание, например, бумаги:
(C6H10O5)n + H2SO4 => H2SO4 + 5nH2O + 6C
При взаимодействии концентрированной серной кислоты с сахаром образуется пористая угольная масса, похожая на черную затвердевшую губку:
C12H22O11 + H2SO4 => C + H2O + CO2 + Q
Химические свойства разбавленной и концентрированной серной кислоты отличаются.
Разбавленныерастворы серной кислоты реагируют с металлами, расположенными в электрохимическом ряду напряжений левее водорода, с образованием сульфатов и выделением водорода.
Концентрированные растворы серной кислоты проявляют сильные окислительные свойства, обусловленные наличием в её молекулах атома серы в высшей степени окисления (+6), поэтому концентрированная серная кислота является сильным окислителем. Так окисляются некоторые неметаллы:
S + 2H2SO4 => 3SO2 + 2H2O
C + 2H2SO4 => CO2 + 2SO2 + 2H2O
P4 + 8H2SO4 => 4H3PO4 + 7SO2 + S + 2H2O
H2S + H2SO4 => S + SO2 + 2H2O
Она взаимодействует с металлами, расположенными в электрохимическом ряду напряжений металлов правее водорода (медь, серебро, ртуть), с образованием сульфатов, воды и продуктов восстановления серы. Концентрированные растворы серной кислоты не реагируют с золотом и платиной вследствие их малой активности.
а) малоактивные металлы восстанавливают серную кислоту до диоксида серы SO2 :
Cu + 2H2SO4 => CuSO4 + SO2 + 2H2O
2Ag + 2H2SO4 => Ag2SO4 + SO2 + 2H2O
б) с металлами средней активности возможны реакции с выделением любого из трех продуктов восстановления серной кислоты:
Zn + 2H2SO4 => ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 => 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 => 4ZnSO4 + H2S + 2H2O
в) с активными металлами могут выделяться сера или сероводород:
8K + 5H2SO4 => 4K2SO4 + H2S + 4H2O
6Na + 4H2SO4 => 3Na2SO4 + S + 4H2O
г) с алюминием, железом, хромом, кобальтом, никелем концентрированная серная кислота на холод (то есть без нагревания) не взаимодействует - происходит пассивирование этих металлов. Поэтому серную кислоту можно перевозить в железной таре. Однако при нагревании возможно взаимодействие с ней и железа, и алюминия:
2Fe + 6H2SO4 => Fe2(SO4)3 + 3SO2 + 6H2O
2Al + 6H2SO4 => Al2(SO4)3 + 3SO2 + 6H2O
Т.О. глубина восстановления серы зависит от восстановительных свойств металлов. Активные металлы (натрий, калий, литий) восстанавливают серную кислоту до сероводорода, металлы, расположенные в ряду напряжений от алюминия до железа - до свободной серы, а металлы с меньшей активностью - до сернистого газа.
Получение кислот.
1. Бескислородные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде
Неметалл + H2 = Водородное соединение неметалла
H2 + Cl2 = 2HCl
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = Оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + Кислота = Соль + Кислота
2NaCl + H2SO4 = 2HCl + Na2SO4
Основания– это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп.
Основания - это электролиты, которые диссоциируют с образованием катионов металлического элемента и гидроксид-анионов.
Например:
КОН = К+1 + ОН-1
6.Классификация оснований:
1.По числу гидроксильных групп в молекуле:
а)· Однокислотные, молекулы которых содержат одну гидроксидную группу.
б)· Двухкислотные, молекулы которых содержат две гидроксидные группы.
в)· Трехкислотные, молекулы которых содержат три гидроксидые группы.
2. По растворимости в воде: Растворимые и Нерастворимые.
7.Физические свойства оснований:
Все неорганические основания– твердые вещества (кроме гидроксида аммония). Основания имеют разный цвет: гидроксид калия—белого цвета, гидроксид меди—голубого, гидроксид железа—красно-бурого.
Растворимые основания образуют мыльные на ощупь растворы, через что эти вещества получили название щелочь.
Щёлочи образуют лишь 10 элементов периодической системы химических элементов Д. И. Менделеева: 6 щелочных металлов – литий, натрий, калий, рубидий, цезий, франций и 4 щелочноземельных металла – кальций, стронций, барий, радий.
8.Химические свойства оснований:
1. Водные растворы щелочей изменяют окраску индикаторов. фенолфталеин - малиновый, метилоранж - желтый. Это обеспечивается свободным присутствием гидроксогрупп в растворе. Именно поэтому малорастворимые основания такой реакции не дают.
2. Взаимодействуют :
а) с кислотами: Основание + Кислота = Соль + H2O
KOH + HCl = KCl + H2O
б) с кислотными оксидами: Щелочь + Кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
в) с растворами: Раствор щелочи + Раствор соли = Новое основание + Новая соль
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
г) с амфотерными металлами: Zn + 2NaOH = Na2ZnO2 + H2
Амфотерные гидроксиды:
а) Реагируют с кислотами с образованием соли и воды:
Гидроксид меди (II) + 2HBr = CuBr2 + вода.
б). Реагируют с щелочами: итог - соль и вода (условие: сплавление):
Zn(OH)2 + 2CsOH = соль + 2H2O.
в). Реагируют с сильными гидроксидами: итог - соли, если реакция идет в водном растворе: Cr(OH)3 + 3RbOH = Rb3[Cr(OH)6]
Нерастворимые в воде основания при нагревании разлагаются на основной оксид и воду:
Нерастворимое основание = Основной оксид + H2O
Cu(OH)2 = CuO + H2O
Соли– это продукты неполного замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксидных групп в молекулах оснований кислотными остатками.
Соли - это электролиты, которые диссоциируют с образованием катионов металлического элемента и анионов кислотного остатка.
Например:
К2СО3 = 2К+1 + СО32-
Классификация:
Нормальные соли. Это продукты полного замещения атомов водорода в молекуле кислоты атомами неметалла, или продукты полного замещения гидроксидных групп в молекуле основания кислотными остатками.
Кислые соли. Это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Основные соли.Это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками.
Типы солей:
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
Смешанные соли — в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды.
Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей» , органических солей с температурой плавления ниже 100 °C.
Физические свойства:
Большинство солей—твердые вещества белого цвета. Некоторые соли имеют окраску. Например, дихромат калия—оранжевого, сульфат никеля—зеленого.
По растворимости в воде соли делятся на растворимые в воде, малорастворимые в воде и нерастворимые.
Химические свойства:
Растворимые соли в водных растворах диссоциируют на ионы:
1. Средние соли диссоциируют на катионы металлов и анионы кислотных остатков:
KCl = K + Cl
· Кислые соли диссоциируют на катионы металла и сложные анионы:
KHSO3 = K + HSO3
· Основные металлы диссоциируют на сложные катионы и анионы кислотных остатков:
AlOH(CH3COO)2 = AlOH + 2CH3COO
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла: Ме(1) + Соль(1) = Ме(2) + Соль(2)
CuSO4 + Fe = FeSO4 + Cu
3. Растворы взаимодействуют с щелочами Раствор соли + Раствор щелочи = Новая соль + Новое основание:
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
4. Соли взаимодействуют с кислотами Соль + Кислота = Соль + Кислота:
BaCl2 + H2SO4 = BaSO4 + 2HCl
5. Соли могут взаимодействовать между собой Соль(1) + Соль(2) = Соль(3) + Соль(4):
AgNO3 + KCl = AgCl + KNO3
6. Основные соли взаимодействуют с кислотами Основная соль + Кислота = Средняя соль + H2O:
CuOHCl + HCl = CuCl2 + H2O
7. Кислые соли взаимодействуют с щелочами Кислая соль + Щелочь = Средняя соль + H2O:
NaHSO3 + NaOH = Na2SO3 + H2O
8. Многие соли разлагаются при нагревании: MgCO3 = MgO + CO2
Представители солей и их значение:
Соли повсеместно используются как в производстве, так и в повседневной жизни:
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
- Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
- Хлорид калия используют в сельском хозяйстве как калийное удобрение.
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
- Декагидрат сульфата натрия используют в качестве сырья для получения соды.
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия,нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
- Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты иапатиты используются в качестве сырья в производстве фосфорных удобрений,например, суперфосфата и преципитата.
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
- Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
- Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах.
Генетической называют связь между веществами разных классов, основанную на их взаимопревращениях.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле.
Контроль знаний:
1.Дать определение солям, основаниям, кислотам, их характеристику, основных характерных реакций.
2.Почему кислоты и основания объединяются в группу гидроксиды? Что у них общего и чем они отличаются? Почему щелочь нужно приливать к раствору соли алюминия, а не наоборот?
3. Задание: Приведите примеры уравнений реакций, иллюстрирующих указанные общие свойства нерастворимых оснований.
4. Задание: Определите степень окисления атомов металлических элементов в приведенных формулах. Какая закономерность прослеживается между их степенью окисления в оксиде и основе?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.162-172,пересказ конспекта лекции №5.
Записать уравнения возможных реакций согласно схемам, указать типы реакций: а) НСl + СаО 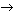 ... ;
... ;
б) НСl + Аl(ОН)3 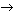 ... ;
... ;
в) Mg + HCl 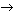 ... ;
... ;
г) Hg + HCl 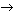 ... .
... .
Разделить вещества по классам соединений. Формулы веществ: H2SO4, NaOH, CuCl2, Na2SO4, CaO, SO3, H3PO4, Fe(OH)3, AgNO3, Mg(OH)2, HCl, ZnO, CO2, Cu2O, NO2
Лекция № 6.
Тема: Металлы. Положение металлических элементов в периодической системе. Нахождение металлов в природе. Металлы. Взаимодействие металлов с неметаллами (хлором, серой и кислородом).
Оборудование: периодическая система химических элементов, коллекция металлов, ряд активности металлов.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Положение элементов - металлов в периодической системе, строение их атомов.
2. Металлы как простые вещества. Металлическая связь, металлические кристаллические решетки.
3. Общие физические свойства металлов.
4. Распространенность металлических элементов и их соединений в природе.
5. Химические свойства элементов-металлов.
6. Понятие о коррозии.
Содержание лекции:
Дата добавления: 2016-01-26; просмотров: 23936;
