Химические свойства.
1. Легко реагируют с кислородом воздуха. Литий при окислении образует оксид Lі2O, остальные - пероксиды и супероксиды:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2.Легко и со взрывом реагируют с водой: 2Na + 2H2O = 2NaOH + H2 3.Легко реагируют с неметалами: Na + S = Na2S 2K + Br2 = 2KBr
За исключением бериллия и радия, все они являются достаточно ковкими, пластичными и мягкими, хоть и тверже щелочные металлы. Бериллий отличается значительной твердостью и хрупкостью, барий при резком сильном ударе раскалывается на отдельные куски.
Температуры плавления и кипения этих металлов выше, чем в щелочных, причем с ростом порядкового номера Тпл. меняются не монотонно, что связано с измененной типа кристаллических решеток От Be к Mg при одинаковом типе решетки температуры плавления уменьшаются. При переходе от Mg к Са изменяется тип кристаллической решетки, поэтому Тпл. (Mg) < Тпл. (Са). Затем, начиная от Са, температуры плавления вновь уменьшаются. Тип связи - металлический - предопределяет высокую тепло - и электропроводность.
Бериллий и магний покрыты оксидной пленкой и не изменяются на воздухе. Благодаря химической активности и для предотвращения взаимодействия с воздухом щелочноземельные металлы хранят в запаянных ампулах, под слоем керосина.
Таблица химических свойств щелочноземельных металлов.
| Условия протекания реакции | Продукты реакции | Примеры уравнений реакции |
| Выявляют свойства активных восстановителей, приобретают степень окисления + 2 | ||
| Взаимодействия с простыми веществами | ||
| С кислородом воздуха | Оксиды | 2Mg + O2 = 2 MgO 2Ca + O2 = 2 CaO |
| С серой при нагревании | Сульфиды | Ba + S = BaS Mg + S = MgS Ca + S = CaS |
| С галогенами | Галогениды | Ca + Cl2 = CaCl2 Mg + Br2 = MgBr2 Ba + I2 = BaI2 |
| С азотом при нагревании | Нитриды | 3Ba + N2 = Ba3N2 2Ca + N2 = Ca3N2 Mg + N2 = Mg3N2 |
| С фосфором при t0 | Фосфиды | 3Ca + 2 P = Ca3P2 3Mg + 2 P = Mg3P2 |
| С водородом при нагревании | Гидриды | Ca + H2 = CaH2 Mg + H2 = MgH2 |
| Взаимодействие со сложными веществами | ||
| Магний свободно растворяется в воде кипящей, остальные металлы энергично-взаимодействуют с водой | Гидроксид и водород | Ba + 2H2O = Ba(OH)2 + H2↑ Mg + H2O = MgO + H2↑ Ca + 2H2O = Ca(OH)2 + H2↑ |
| Все металлы растворяются в сильных кислотах | Соль и водород | Ca + 2HCl = CaCl2 + H2↑ Mg+ H2SO4 = MgSO4+ H2↑ |
Оксиды и гидроксиды щелочноземельных элементов имеют четко выраженные основные свойства. В подтверждение этого проведем демонстрационный опыт. К небольшому количеству порошка кальций оксида, насыпанного в фарфоровую чашку, добавим воды - наблюдаем бурное взаимодействие, сопровождающееся вспениванием содержимого чашки. Если к полученному раствору добавить несколько капель индикатора фенолфталеина, то он вступит малинового цвета, что свидетельствует о наличии щелочи:
СаО + Н20 = Са(ОН)2
(эта реакция имеет название «гашение» негашеной извести).
Добывают в технике термическим разложением соответствующих природных карбонатов:
MgCO3 = MgO + CO2↑ CaCO3 = CaO + CO2↑
Все оксиды - тугоплавкие вещества. Магний оксид с водой не реагирует; оксиды щелочноземельных элементов энергично реагируют с водой:
MgO + H2O ≠ BaO + H2O = Ba(OH)2
CaO + H2O = Ca(OH)2
Выявляют характерные свойства основных оксидов: реагируют с кислотами и кислотными оксидами с образованием солей.
MgO + H2SO4 = MgSO4 + H2O
CaО+H2S04 = CaS04+ Н20
CaO + SO3 = CaSO4
Гидроксиды Магния и щелочноземельных элементов.
Магний гидроксид добывают из растворимых солей Магния действием растворов щелочей:
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
Гидроксиды щелочноземельных металлов получают при взаимодействии соответствующих оксидов с водой:
SrO + H2O = Sr(OH)2
Mg(OH)2 - плохо растворим в воде, основание средней силы. Кальций гидроксид (гашеная известь) - малорастворимое в воде вещество. Насыщенный раствор Са(ОН)2 - называют известковой водой. Sr(OH)2 и Ba(OH)2 - гидроксиды хорошо растворимые в воде. Гидроксиды Магния и щелочноземельных элементов разлагаются при нагревании:
Ba(OH)2 = BaO + H2O
Mg(OH)2 = MgO + H2O
Другое общее свойство этих гидроксидов - взаимодействие в растворимые с кислотами и кислотными оксидами с образованием солей:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Вследствие осаждения ВаСО3 раствор баритовой воды мутнеет; эта реакция используется для обнаружения углекислого газа.
Распространение в природе: Содержание Кальция в земной коре - 4,1%, а Магния - 1,87 %. Кальций и Магний входят в состав осадочных горных пород, различных минералов (известняк, мрамор, мел - СаСО3, гипс - СаSO4 • 2Н2O; фосфориты и апатиты - Са3(РO4)2; доломит - СаСО3 • МgСО3, магнетит - МgСО3).
Применение: Магний - для получения легких сплавов (дюралюминия). Добавляют его и к чугунку с целью улучшения механических свойств чугуна. Кальций - используют в металлургии для очистки чугунка и стали от оксидов.
Гидроксиды щелочных металлов NaOH, KOH- кристаллические вещества ионного строения, белого цвета, легко поглощают влагу, особенно натрий гидроксид NaOH, хорошо растворяются в воде с выделением большого количества теплоты. Гидроксиды натрия и калия разъедают ткани, кожу, органические вещества, поэтому их называют едкими щелочами.
В водных растворах гидроксиды щелочных металлов полностью диссоциируют на ионы:
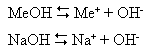
Действие кислот на индикаторы:
| Лакмус | Метиловый -оранжевый | Фенолфталеин | Универсальный индикатор |
| Синий | Желтый | Малиновый | Синий |
|
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
1. Взаимодействие с кислотными оксидами:
2KOH + SO3 = K2SO4 + H2O
2NaOH + SiO2 = Na2SiO3 + H2O – сплав
2. Взаимодействие с амфотерными оксидами:
2NaOH + ZnO = Na2ZnO2 + H2O – сплав
2KOH + Al2O3 = 2KAlO2 + H2O – сплав
3. Взаимодействие с амфотерными гидроксидами:
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O – сплав
2NaOH + Zn(OH)2 = Na2[Zn(OH)4] - в растворе
4. Взаимодействие с металлами, которым соответствуют амфотерные гидроксиды:
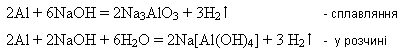
5.Взаимодействие с солями:
Реакция между гидроксидами и солями происходит по типу реакции обмена, которая проходит только в растворе, при этом образуются основные соли, или нерастворимые в воде основания:
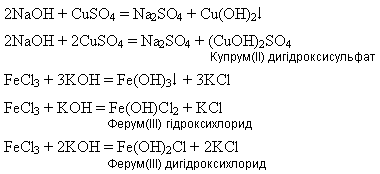
6. Взаимодействие с ацетатом натрия:
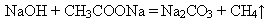
Жесткость воды, ее виды, методы ее устранения.
Жесткость воды - свойство природной воды, обусловленная наличием в ней растворенных солей Кальция и Магния. Суммарное их содержание в воде называется общей жесткостью.
Жесткость воды бывает двух типов:
- карбонатная (временная);
- не карбонатная (постоянная).
Чем выше в воде содержание ионов Са2+ та Mg2+, тем большей будет ее твердость.
Карбонатная жесткость воды обусловливается тем, что взаимодействуя с карбон (IV) оксидом, который содержится в воздухе, карбонаты Кальция и Магния превращаются в растворимые кислые соли – гидрогенкарбонаты:
СО2 + Н2О ® Н2СО3
СаСО3 + Н2О + СО2 → Са(НСО3)2
MgCO3 + Н2О + СО2 → Mg(НСО3)2
Карбонатную или временную жесткость воды можно устранить простым кипячением, в результате которого гидрогенкарбонаты превращаются в нерастворимые в воде карбонаты Кальция и Магния:
Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑
Mg(НСО3)2 = MgCO3↓ + Н2О + СО2↑
Другой способ устранения временной жесткости - действие известковым молоком или содой:
Ca(OH)2 + Ca(HCO3)2 = 2CaCO3↓ + 2H2O
Ca(OH)2 + Mg(HCO3)2 = CaCO3↓ + MgCO3↓ + 2H2O
Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3
Mg(HCO3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3
Некарбонатная или постоянная жесткость воды обусловлена содержанием в воде сульфатов и хлоридов Кальция и Магния. Ее также можно устранить, но сделать это гораздо труднее.
Постоянную жесткость воды устраняют действием соды или натрий ортофосфата. При этом происходят следующие реакции:
Ca2+ + Na2CO3 = CaCO3↓ + 2Na+
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
3MgSO4 + 2Na3РO4 = Mg3(РO4)2↓ + 3Na2SO4
Для хозяйственно-бытовых нужд следует использовать воду с незначительной твердостью, ибо от ее кипячения образуется накипь.
Накипь плохо проводит теплоту, поэтому возможен перегрев двигателей, паровых котлов, кроме того, ускоряется их износ.
Жесткая вода затрудняет крашение и стирка ткани, не пригодна для варки мыла и приготовления эмульсий в парфюмерном производстве.
Контроль знаний:
1. Дайте определение карбонатной жесткости воды.
2. Какие средства ее устранения вам известны?
3. Какие ионы обусловливают жесткость воды?
4. Какие способы устранения карбонатной жесткости вы знаете?
5. Запишите формулы соединения, которая имеет электронную конфигурацию:
а). …3s23p4 б). …6s26p2 в). …4s24p4. г) …4s13d5
6. Назовите элементы, которые относят к щелочным металлов.
7. Какую роль в организме имеют щелочные металлы?
8. Напишите уравнения химических реакций, чтобы осуществить цепочку превращений: Ca → CaO → Ca(OH)2 → CaCO3 → CaHCO3
9. В чем причина различия между свойствами алюминия, кальция и калия?
• Как можно объяснить эти различия учитывая строение их атомов?
- Могут ли быть Al изделия дороже золотых?
– В каких цистернах можно без боязни перевозить
кислоты HNO3 и H2SO4?
– Почему щелочные растворы нельзя хранить в алюминиевой посуде?
– Почему бытовые изделия из алюминия служат долго и не подвергаются коррозии?
–Недавно во Флориде построен первый дом из алюминия. Алюминий был получен при переработке вторичного сырья. Всего на сооружение дома потребовалось более полмиллиарда единиц этого вторичного сырья. Что это за сырьё?
- Почему алюминий называют металлом будущего?
Задача: Доля железа в организме человека 0,005-0,006% от общей массы тела. Зная массу своего тела, вычислите массу железа в вашем организме. Ответ. Например, масса тела 60 кг: m(Fe) = 60 кг • 0,005 : 100% = 0, 003кг(3г).
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л2.стр.124-133,пересказ конспекта лекции №8.
Дописать уравнения реакций:
1) Na2O2 + KJ + H2SO4 = J2 +
2) Na2O2 + Fe(OH)2 + H2O =
3) NaH + H2O = H2 + …
4) Na2O2 +KMnO4 + H2SO4 = MnSO4
5) Na + H2 =
6) Li3N + H2 = LiH +
Подготовить сообщения:
1. Положение алюминия в периодической системе, строение атома.
2. Физические свойства алюминия.
3. Природные соединения алюминия.
4. Способы получения алюминия.
Решить задачу: Гидрид натрия NaH взаимодействует с водой с образованием щелочи и газообразного водорода. Напишите химическое уравнение этой реакции. Вычислите объем водорода, образующегося из 60 г. гидрида натрия.
ОРГАНИЧЕСКАЯ ХИМИЯ
Лекция № 8.
Тема: Введение: Предмет органической химии. Сравнение органических соединений с неорганическими. Валентность. Основные положения теории химического строения органических соединений. Понятие о гомологии и гомологах, изомерии и изомерах.
Основные понятия и термины по теме:изомеры, углеродный скелет, углеводороды, функциональные группы, гомологические группы и ряды, номенклатура органических соединений, радикальные реакции, галогенирование, полимеризация.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Предмет органической химии. Сравнение органических соединений с неорганическими.
2. Теория химического строения органических соединений А. М. Бутлерова.
3. Явление изомерии. Структурная изомерия, номенклатура.
4.Значение теории химического строения.
5. Многообразие органических соединений.
6. Классификация насыщенных углеводородов, номенклатура.
Содержание лекции:
Дата добавления: 2016-01-26; просмотров: 2397;
