Явление изомерии. Структурная изомерия, номенклатура.
Вещества, имеющие одинаковый состав, но разное химическое или пространственное строение, а следовательно, и разные свойства, называют изомерами. Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах:
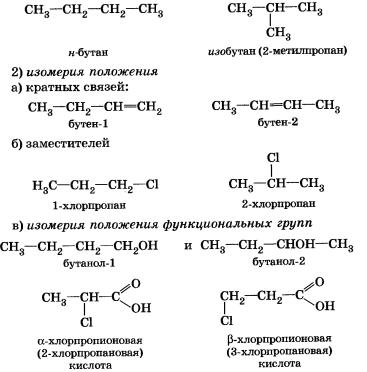
1) изомерия углеродного скелета
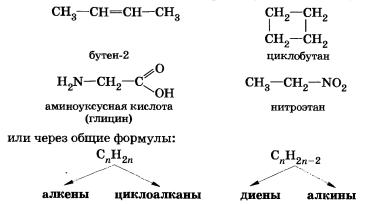
2) изомерия гомологических рядов (межклассовая)
Пространственная изомерия, при которой молекулы веществ отличаются не порядком связи атомов, а положением их в пространстве: цис-транс-изомерия (геометрическая).
Эта изомерия характерна для веществ, молекулы которых имеют плоское строение: алкенов, циклоалканов и др.
Если два атома Углерода образуют двойную связь, то валентные орбитали каждого из них находятся в состоянии sp2 - гибридизации. Каждый из атомов Углерода образует по три связи, которые находятся в одной плоскости и направлены к вершинам равностороннего треугольника. Связь между атомами Углерода расположен в плоскости, что является перпендикулярной к плоскости, в которой расположены связи. То есть, связи и связь расположены во взаимно перпендикулярных плоскостях.
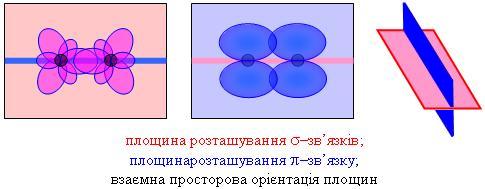
Рассмотренное строение молекул с двойной связью обусловливает так называемую цис - и транс - изомерию. К цис - изомеров относят такие, которые имеют одинаковые заместители по одну сторону от плоскости, в которой расположена связь. К транс -изомерам относят такие, которые имеют одинаковые заместители по разные стороны от плоскости, в которой расположена связь.
К пространственной изомерии относится и оптическая (зеркальная) изомерия.
Четыре одинарные связи вокруг атома углерода, как вы уже знаете, расположены тетраэдрически.
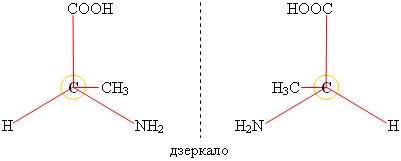
Если атом углерода связан с четырьмя различными атомами или группами, то возможно разное расположение этих групп в пространстве, то есть две пространственные изомерные формы.
Представьте себе, что молекулу аланина поместили перед зеркалом. Группа —NH2 находится ближе к зеркалу, поэтому в отражении она будет впереди, а группа —СООН — на заднем плане и т. д. (см. изображение справа). Алании существует в двух пространственных формах, которые при наложении не совмещаются одна с другой.
Динамическая изомерия (таутомерия) определяется сосуществованием различных изомеров, которые при обычных условиях могут переходить один в другой.
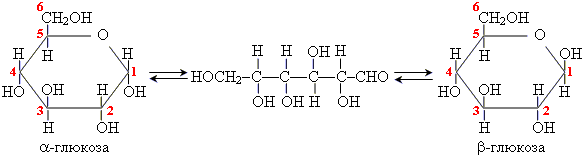
Глюкоза может образовывать одну линейную и две циклические формы сосуществуют при обычных условиях:
β- Глюкоза и α-глюкоза отличаются положением гидроксогрупп у атома Углерода С1.
Универсальность второго положения теории строения химических соединений подтверждает существование неорганических изомеров.
Так, первый из синтезов органических веществ — синтез мочевины, проведенный Велером (1828 г.), показал, что изомерны неорганическое вещество — цианат аммония и органическое — мочевина:

Если заменить атом кислорода в мочевине на атом серы, то получится тиомочевина, которая изомерна роданиду аммония, хорошо известному вам реактиву на ионы Fе3+. Очевидно, что тиомочевина не дает этой качественной реакции.
Третье положение. Свойства веществ зависят от взаимного влияния атомов в молекулах.Например, в уксусной кислоте в реакцию со щелочью вступает только один из четырех атомов водорода. На основании этого можно предположить, что только один атом водорода связан с кислородом:
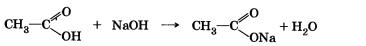
Чтобы убедиться в универсальности положения теории строения о зависимости свойств веществ от взаимного влияния атомов в молекулах, которое существует не только у органических, но и у неорганических соединений, сравним свойства атомов водорода в водородных соединениях неметаллов. Они имеют молекулярное строение и в обычных условиях представляют собой газы или летучие жидкости. В зависимости от положения неметалла в Периодической системе Д. И. Менделеева можно выявить закономерность в изменении свойств таких соединений:
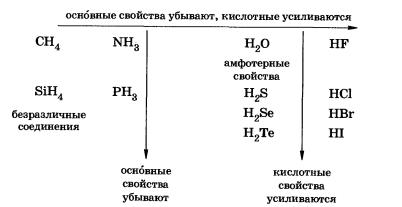
Метан не взаимодействует с водой. Отсутствие основных свойств у метана объясняется насыщенностью валентных возможностей атома углерода.
Аммиак проявляет основные свойства. Его молекула способна присоединять к себе ион водорода за счет его притяжения к не поделённой электронной паре атома азота (донорно-акцепторный механизм образования связи).
В периодах слева направо увеличиваются заряды ядер атомов, уменьшаются радиусы атомов, увеличивается сила отталкивания атома водорода с частичным положительным зарядом §+, а потому кислотные свойства водородных соединений неметаллов усиливаются.
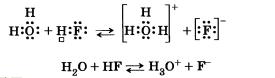
4.Значение теории химического строения А. М. Бутлерова для органической химии можно сравнить со значением Периодического закона и Периодической системы химических элементов Д. И. Менделеева для неорганической химии.
Теория объяснила неясности и противоречия в знаниях об окружающем мире; творчески обобщила достижения в области химии; представила качественно новый подход к пониманию строения и свойств веществ; указала направления и возможные пути получения новых веществ, необходимых людям.
Номенклатура органических веществ и ее виды.Номенклатура – совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления их названий. Название вещества должно отражать не только его качественный и количественный состав, но и однозначно показывать его химическое строение, названию должна соответствовать единственная формула строения.
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — (Международного союза теоретической и прикладной химии).
(Вспомним русский язык. Из каких частей состоит слово? : Приставка, корень, суффиксы, окончание.)
Название органического соединения так же состоит из приставки (префикса), корня, суффикса первого порядка, суффикса второго порядка. Корень слова определяет основную цепь органического соединения, зависит от количества атомов в цепи.
Префиксы указывают на наличие функциональной группы (кроме старшей), радикалы. Радикалы образованы из предельных углеводородов отнятием водорода от конечного углеродного атома называют заменяя суффикс «ан в названии углеводорода суффиксом «ил». Например, метан- метил.(Кассы неорганических соединений и название характеристических групп.)
Суффикс первого порядка указывает на определенный вид связи атомов углерода в соединении. Суффикс второго порядка указывает на наличие старшей функциональной группы.
В названии органического соединения используют локанты и множительные приставки. Локанты – цифры или буквы указывающие положение заместителей и кратных связей. Они могут ставятся перед префиксом или после суффикса. Множительные приставки указывают число одинаковых заместителей или кратных связей. ( ди-, три-, тетро-, пенто-) Составления структурных формул по названию органического соединения. Разберем на составные части название органического соединения:
3-этилпентан .
Определим корень (слово, указывающее наибольшее количество атомов углерода) пент. Выделим значком для корня. Перед корнем выделяем префикс 3-этил. После корня укажем суффикс «ан».

Составим структурную формулу по плану:
1. Составляем цепь из углеродов, в количестве указанном в корне.
2. Прономеруем атомы углерода.
3. Укажем радикал у третьего атома углерода, согласно префиксу.
4. Суффикс «ан» указывает на одинарную связь между атомами углерода.
5. Допишем недостающие атомы водорода, согласно валентности.
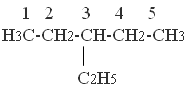
Составьте, самостоятельно, в тетрадях структурную формулу
2-метилбутанол-2.
А 15 B молекуле этилена имеются
| 1) | две s- и две p-связи |
| 2) | две s- и три p-связи 
|
| 3) | пять s- и одна p-связь Корень эт - С2 ; Суффикс илен = связь |
| 4) | три s- и две p-связи
проставим недостающие атомы водорода
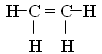 Ответ: пять s- и одна p-связь. А 15—3
Ответ: пять s- и одна p-связь. А 15—3
|
Дата добавления: 2016-01-26; просмотров: 4166;
