Положение элементов - металлов в периодической системе, строение их атомов.
Из 110 элементов периодической системы более 80 - металлы.
Металлы –это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы.
Металличность определяется способностью атомов отдавать электроны. Чем меньше надо отдать электронов и чем легче их отдавать, тем ярче выражены металлические свойства атомов.
К элементам-металлам относятся s-элементы (за исключением Н и Не), все d - и f-элементы. Среди p-элементов металлические размещены в левой части периодической системы химических элементов под диагональю Бор В - Астату At. Также металлами являются элементы побочных подгрупп, т.к. они имеют на последнем слое 2 электрона и у них происходит заполнение d-подуровня предпоследнего слоя.
Для большинства элементов-металлов характерно небольшое количество электронов на внешнем энергетическом уровне их атомов (от 1 до 3) и сравнительно большие радиусы атомов(сурьма, висмут – 5, полоний - 6 электронов, но большой радиус атома), что обусловливает способность атомов металлов легко терять валентные электроны и образовывать положительно заряженный ион. Наиболее активным металлом является франций.
( Краткая запись в конспект: I, II, III, группы( исключение Н, He, B), главные подгруппы, побочные подгруппы, лантаноиды, актиноиды. На внешнем энергетическом уровне 1-3 электрона ( s или p ), в образовании связи принимают участие d- е предыдущего уровня. Все металлы имеют во внешней оболочке по одному или два электрона, могут легко их отдавать, образуя ионы с устойчивыми конфигурациями благородных газов. Заряд катиона равен количеству отданных электронов): ( Ме - ne-= Men+)
2. Металлы как простые вещества. Металлическая связь, металлические кристаллические решетки.
Металлические элементы образуют простые вещества, то есть металлы. Например, Алюминий - алюминий; Феррум - железо; Купрум - медь; Аргентум — серебро.
Для металлов характерной является общая металлическая связь и физические свойства, вид химической связи - металлический. Металлическая связь – это связь между атомами и катионами металла посредством обобществённых электронов. Металлическая связь является не направленной, поскольку валентные электроны распределены по всему кристаллу почти равномерно. Он существует в кристаллах и расплавах металлов и сплавов, в чистом виде характерен для щелочных и щелочноземельных металлов. У переходных металлов связь между атомами частично ковалентным.
Металлы имеют металлическую кристаллическую решётку в узлах которой находятся атомы и катионы металлов, вследствие отдачи отдельными атомами валентных электронов, а пространство между ними заполнено «электронным газом», становятся обобществленными всеми ионами металла и прочно связывают.
Все металлы имеют кристаллическое строение. Тип решетки зависит от химической природы и фазового состояния металла. Она имеет формы: гексагональную, кубическую, гранецентрированную, объёмноцентрированную.
3. Общие физические свойства металлов.
Наличие металлического связи обуславливает общие свойства металлов. Она определяет физические свойства металлов:
а) агрегатное состояние-все металлы твёрдые вещества и кристаллического строения, кроме ртути Hg и францию Fr; . Твердость – все металлы кроме ртути и галия, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром Cr и вольфрам W. – царапает стекло.
б) цвет- с металлическим блеском от серебристо-белого цвета (Ag, Al, Ni, Pa) до темного серебристо-серого (Fe, Pb), за исключением золота Au и меди Cu.
Металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Лучше всего отражают свет индий In и серебро Ag. В порошке все металлы, кроме АI и Мg, теряют блеск и имеют черный или темно – серый цвет. По окраске металлы условно делят на черные и цветные.К черным металлам чаще всего относят железо и его сплавы (чугун, сталь). Все другие - называют цветными.
в) плавкость. Металлы делятся на легкоплавкие( tпл 350,самые низкаие: Hg= - 38,87, ), галий «плавится» на ладони, и тугоплавкие( tпл< 350-3 370- W). Легкоплавкие tпл - натрий, магний, алюминий; тугоплавкие - медь, железо, хром, титан, молибден.
г) электропроводность, теплопроводность металлов обусловлена их строением. (за счёт свободных электронов) и увеличивается в ряду напряжений Ме-ла ( Ag наивысший,на втором месте - медь Cu, далее золото Au и алюминий Al.).
Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. Металлы — хорошие проводники электрического тока и теплоты, причем их электро - и теплопроводность уменьшаются с повышением температуры.
Теплопроводность самая высокая у Hg.Холод металла объясняется тем что тепло ладони быстро передаётся Ме-лу, он становится более тёплым. А ладонь холодеет.
д) плотность. Металлы делятся на лёгкие, мягкие (0,5г/см- Li) и тяжелые (22.5г/см- Осмий). Среди тяжелых металлов (плотность более 5 г/см3) - цинк, железо, медь, свинец, ртуть, золото. Отличие по температуре плавления: Ртуть при комнатной температуре остается жидким и затвердевает только при температуре - 38,50 С; галлий плавится от тепла руки - его температура плавления составляет + 29,50 С, а чтобы расплавить вольфрам, его нужно нагреть до 34500С
е) пластичность (ковкость) — способности под ударами изменять свою форму без разрыва химических связей, объясняется возможностью перемещения (скольжения) одних слоёв металлов относительно других благодаря наличию «электронного газа». И поэтому металл характеризуется высокой пластичностью. Их можно прокатывать в тончайшие листы, проволоку, тоньше волоса. (самым ковким элементом есть золото - по 1 г этого металла можно вытянуть проволоку длиной 2,4 км в несколько сотен раз тоньше волоса). Стибий самый хрупкий (хром, манган тоже) — его можно растереть в порошок.
Все s-металлы горят в атмосфере воздуха, образуя оксиды одного или нескольких типов — оксиды состава Ме2О (I группа) и МеО (II группа), пероксиды состава Ме2О2(I группа) и МеО2(II) группа. Медь горит зелёным, Теллур горит синим, кальций - оранжево-красный, карминно-красный — литий. Магний и алюминий - ослепительно белый. Натрий придаёт пламени жёлтый цвет. Если в пламя внести крупинку поваренной соли (хлористого натрия, NaCl), то пламя окрашивается в интенсивный желтый цвет, и спектральный аппарат обнаруживает в желтой части спектра две близко расположенные линии, характерные для спектра паров натрия; KCl - в фиолетовый; Зеленая окраска пламени — "визитная карточка" бария, даже если он присутствует в микроскопических количествах. Когда во время салютов вы видите зеленые ракеты или как, разбрасывая искры, медленно горит зеленый бенгальский огонь, вспомните, что в их составе обязательно есть соли бария. К примеру, в состав зеленого бенгальского огня входят Ba(NO3)2 и BaCl2; От стронция пламя будет красным. Дополнение: «Несгораемая бумага»: Приготавливают насыщенный раствор калийной селитры KNO3, опускают в него на 5-7 минут лист газетной бумаги. По истечении указанного времени его вынимают из раствора и сушат. Затем вносят в пламя горелки, он не горит, а тлеет.
Можно приводить еще много примеров значительных различий в физических свойствах различных металлов.
Что же лежит в основе единства веществ, которые имеют свойства металлов?
Одна из главных идей химии заключается в том, что свойства веществ зависят от их состава и строения . Физические свойства металлов зависят не только от строения внешних электронных оболочек атомов, но и от других причин. 4.Применение металлов. Распространенность металлических элементов и их соединений в природе.
Эпиграф: «В начале был век
медный».
Все s - металлы встречаются в природе только в виде соединений, либо в составе минералов (KCI, NaCI, СаСОз и т.п.), либо в виде ионов в морской воде. Одни из них очень редко встречаются в природе, а некоторые наоборот, являются очень распространенными, например алюминий, железо, медь.
Так, кальций, натрий, калий и магний по распространенности на Земле занимают соответственно пятое, шестое, седьмое и восьмое места. Стронций распространен в умеренных количествах. Остальные s - металлы составляют незначительную часть земной коры и океанических вод.
Металлы имеют огромное значение в развитии человеческой цивилизации. С давних времен человечеству известны золото, серебро, медь и железо. Современная металлургия получает для нужд техники более 60 металлов и на их основе более 5000 сплавов.
Подавляющее большинство металлов встречается в природе в виде различных соединений. В свободном состоянии в земной коре встречаются лишь некоторые металлы:(это так называемые самородные металлы): золото Au, платина Pt и платиновые металлы - осмий Os, иридий Ir, рутений Ru, родий Rh, палладий Pd, иногда серебро Ag, ртуть Hg и медь Cu.
Природные минеральные соединения, из которых экономически целесообразно добывать металл в производственных условиях называют рудами. Важнейшими рудами являются оксиды, сульфиды и карбонаты металлических элементов.
Первым этапом переработки руд является удаление пустой породы - обогащение руды. Добывание металлов из руд основано на их восстановлении разными способами.
Природные минеральные образования, из которых технологически возможно и экономически целесообразно добывать металлы, называют рудами.В состав руды, кроме полезных минералов, входит еще пустая порода.
Важными рудами являются оксиды (Fe2O3, Fe3O4, Al2O3 • nH2O, MnO2 и др);сульфиды (ZnS, PbS, Cu2S, HgS и др.), соли (NaCl, KCl, MgCl2 CaCO3 и т. д.). Малоактивные металлы встречаются преимущественно в виде оксидов и сульфидов, а активные (щелочные и щелочноземельные) - исключительно в виде солей. В свободном состоянии в природе встречаются только неактивные металлы.
В зависимости от того, какие соединения металлов, содержащихся в руде, различают:
-оксидные руды - Fe3O4, Al2O3
-сульфидные руды - FeS2, MoS2
-хлоридные руды - NaCl, MgCl2
-карбонатные руды - CaCO3, FeCO3
Металлические руды - основное сырье металлургии, отрасли промышленности, производящей металлы.
Биологическая роль металлов:
- Кальций входит в состав костей и крови, а также в состав мела и извести;
- Магний - основа магнезии MgO, которую применяют в медицине при лечении повышенной кислотности и изжоги или при отравлении кислотами;
- Калий входит в состав минеральных удобрений и является необходимым для производства стекла и линз;
- Натрий входит в состав поваренной соли; простое вещество Na является основой пиропатрона, что надувает подушки безопасности в автомобилях;
- Палладий применяют в изготовлении белого золота или зубных протезов;
- Тантал и титан применяют в производстве костных протезов;
- Литий является частью аккумуляторов, в частности литий - ионного аккумулятора, а его соли используют в лечении психических заболеваний.
5.Химические свойства элементов-металлов. Во всех химических реакциях металлы являются восстановителями:
Характерной особенностью металлов является способность их атомов отдавать свои валентные электроны и образовывать положительно заряженные ионы. В отличие от неметаллов металлы отрицательно заряженных ионов не образуют. Итак, свободные металлы являются восстановителями. Чем легче данный металл отдает свои валентные электроны, тем он активнее восстановитель.
По химической активности металлы можно распределить на три группы: сильно активные - калий, натрий, барий, кальций и др., средней активности - цинк, железо, никель и т.п. и мало активные - серебро, золото и платина.
По активности металлы располагаются в ряд (ряд Бекетова, вытеснительными ряд, активности, электрохимический ряд металлов):
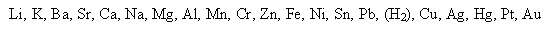

уменьшение химической активности
- каждый металл этого ряда может вытеснить из водного раствора соединения любой из металлических элементов, что стоит справа от него, и может быть вытеснен любым из металлов, стоящих слева;
- все металлы, стоящие левее водорода, могут вытеснять Водород из кислот, а те, что стоят справа, - не могут;
- чем левее стоит металл в ряду, тем он более сильный восстановитель и тем труднее восстановить его.
Металлы:
Взаимодействуют с неметаллами:При различных условиях металлы взаимодействуют с неметаллами, причём, чем больше активность металла и неметалла, тем мягче условия протекания реакции. Магний взаимодействует с серой с образованием сульфида магния, но для начала реакции требуется нагревание: Mg0+ S0= Mg+2S-
Взаимодействие с галогенами:Каждый галоген является самым сильным окислителем в своем периоде. Элементы главной подгруппы VII группы Периодической системы, объединенные под общим названием галогены, фтор P, хлор Сl, бром Вr, иод I, астат Аt Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом, как вы уже знаете, образуются соли (отсюда и название подгруппы). Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются. Например, натрий реагирует с хлором при обычных условиях с образованием хлорида натрия: Na0+ Cl20= 2Na+Cl-. Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы (рис. 17), образуя при этом смесь двух хлоридов сурьмы(ІІІ) и (V).
Взаимодействуют с кислородом:По отношению металлов к кислороду их можно разделить на три группы. Металлы, реагирующие с кислородом при обычных условиях, например, 2Са0+ О20= 2Са+2О-2. Металлы, взаимодействующие с кислородом только при нагревании, например, медь: 2Сu0+ O20= 2Cu+2O-2. И третья группа – это металлы, не взаимодействующие с кислородом, например, золото, платина. Взаимодействуют с серой:В зависимости от активности металла сера может восстанавливаться до сероводорода H2S-2, серы S0или оксида серы(IV) S+4O2.
Взаимодействуют с водой: (щелочные и щелочноземельные металлы взаимодействуют с водой при стандартных условиях с образованием щелочей): 2Na0+ 2H2+1O = 2Na+1OH + H20. Менее активные металлы реагируют с водой при нагревании:Zn0+ H2+1O = Zn+2O + H20.Золото, медь, серебро, платина, ртуть не взаимодействуют с водой. Взаимодействуют с кислотами:С растворами кислот взаимодействуют металлы, стоящие в ряду напряжения до водорода. В результате реакции образуются соль и водород. Например, Zn0+ 2H+1Cl = Zn+2Cl2+ H20. Разбавленная азотная и концентрированные серная и азотная кислоты способны взаимодействовать и с металлами, стоящими в ряду напряжения после водорода. Это объясняется тем, что они проявляют окислительные свойства за счёт S+6и N+5. В результате реакций обязательно образуются соль и вода и ещё продукт восстановления S+6или N+5. Например:
2H2S+6O4(конц.)+ Cu0= Cu0SO4+ H2O + S+4O2
8HN+5O3(разб.)+ 3Cu0= 3Cu+2(NO3)2+ H2O + 2N+2O
4HN+5O3(конц.)+ Cu0= Cu+2(NO3)2+ H2O + 2N+4O2
Взаимодействуют с солями (реакция происходит только в водном растворе: более активные металлы вытесняют менее активные):
Zn0+ Cu+2SO4= Zn+2SO4+ Cu0.
Взаимодействуют с оксидами (активные металлы восстанавливают менее активные из оксидов при нагревании — металлотермия): Окисляемость. Она характеризует способность металлов соединяться с кислородом и образовывать оксиды.
Дата добавления: 2016-01-26; просмотров: 4208;
