Полярность и поляризуемость связи. Дипольный момент связи. Гомолитический и гетеролитический разрыв связи.
Ковалентная связь, в которой обобществленная электронная плотность (обобществленные электроны, связующее электронное облако) симметрична по отношению к ядрам взаимодействующих атомов, называется неполярной ковалентной связью. Такая связь реализуется в молекулах простых веществ, состоящих из одинаковых атомов (Н-Н, О=О, Cl-Cl, N≡N и т. д.). Она может появляться между разными атомами, обладающими одинаковой относительной электроотрицательностью. Например, в молекуле РН3связи Р-Н неполярные ковалентные, т. к. ЭО(Н)=2,1 и ЭО(Р)=2,1.
Ковалентная связь с несимметричным распределением обобществленной электронной плотности называется полярной ковалентной связью.
Если связь образована атомами разной природы и один из атомов сильнее притягивает электроны, то обобществлённая электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон служит электроотрицательность. Чем выше ЭО у атома, тем больше смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательностей атомов (ΔЭО) характеризует полярность связи.
Мерой полярности связи служит электрический момент диполя 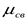 ,равный произведению эффективного заряда δ на длину диполя ℓ:
,равный произведению эффективного заряда δ на длину диполя ℓ:
Электрический момент момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака (или от атома элемента с меньшей ЭО к атому элемента с большей ЭО). Для рассмотренной молекулы HCl:
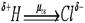
Поляризуемость связи. Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и ее поляризуемость. Последняя характеризует способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля. Так как с каждым атомом или молекулой, в свою очередь, связано электрическое поле, то соединение должно поляризоваться также и при действии на молекулу других молекул, скажем, партнера по реакции.
В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов и образованием отрицательного и положительного ионов. Асимметричный разрыв связи с образованием разноименных ионов называется гетеролитическим:
Полярностью и поляризуемостью молекул обусловлено межмолекулярное взаимодействие. С электрическим моментом диполя молекулы связана реакционная способность вещества, его растворимость. Полярные молекулы жидкостей благоприятствуют электролитической диссоциации растворенных в них электролитов.
ДИПОЛЬНЫЙ МОМЕНТ
электрический, векторная величина, характеризующая асимметрию распределения положит. и отрицат. зарядов в электрически нейтральной системе. Два одинаковых по величине заряда+q и Чq образуют электрич. диполь с Д. м. m = q l, где l- расстояние между зарядами. Для системы из пзарядов <qi</q радиусы-векторы к-рых <ri</r, В молекулах и мол. системах центры положит. зарядов q А совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности r(r). В этом случае Д. м. Вектор Д. м. направлен от центра тяжести отрицат. зарядов к центру тяжести положительных. В хим. литературе Д. м. молекулы иногда приписывают противоположное направление. Часто вводят представление о Д. м. отдельных хим. связей, векторная сумма к-рых дает Д. м. молекулы. При этом Д. м. связи определяют двумя положит. зарядами ядер атомов, образующих связь, и распределением отрицат. (электронного) заряда. Д. м. хим. связи обусловлен смещением электронного облака в сторону одного из атомов. Связь наз. полярной, если соответствующий Д. м. существенно отличается от нуля. Возможны случаи, когда отдельные связи в молекуле полярны, а суммарный Д. м. молекулы равен нулю; такие молекулы наз. неполярными (напр., молекулы СО 2 и CCl4). Если же Д. м. молекулы отличен от нуля, молекула наз. полярной
При гомолитическом,или свободнорадикальном,разрыве ковалентной связи (гомолизе)у каждого из ранее связанных атомов остается по одному электрону. В результате гомолиза связи в качестве промежуточных частиц образуются радикальные реагенты. Гомолиз обычно протекает при облучении или высокой температуре, а также при проведении реакций в газовой фазе.
При гетеролитическомразрывековалентной связи (гетеролизе)электронную пару, связывающую атомы, забирает один из партнеров по связи. При этом образуются электрофильные и нуклеофильные частицы. Гетеролиз ковалентной связи обычно имеет место при проведении реакций в полярных сольватирующих растворителях (например, в воде, спиртах), причем образующиеся в качестве интермедиатов электрофильные и нуклеофильные частицы сольватируются растворителем.
В соответствии с характером разрыва связи в субстрате и природой реагента различают реакции:
• радикальные;• ионные;• согласованные.
В радикальных, или гомолитических, реакциях участвуют радикальные реагенты и происходит гомолитический разрыв ковалентной связи в субстрате. Ионные, или гетеролитические, реакции сопровождаются гетеролизом связи в субстрате. В зависимости от природы атакующего реагента они могут быть электрофильными (символ Е) или нуклеофильными (символN). В качестве промежуточных частиц в гетеролитических реакциях принимают участие карбокатионы и карбанионы.Синхронные (согласованные) реакции протекают при облучении или нагревании. В качестве примера может быть приведена реакция диенового синтеза (общий метод получения разнообразных циклическихсоединений). Для согласованных реакций теряют смысл понятия реагента и субстрата.
Дата добавления: 2016-01-16; просмотров: 3019;
