Понятие о термодинамике открытых систем. Стационарное состояние организма и его подсистем.
Термодинамические открытые системы активно взаимодействуют с внешней средой, причем наблюдатель прослеживает это взаимодействие не полностью, оно характеризуется высокой неопределённостью. При определённых условиях такая открытая система может достигать стационарного состояния, в котором её структура или важнейшие структурные характеристики остаются постоянными, в то время как система осуществляет со средой обмен веществом, информацией или энергией — этот процесс называется гомеостазом. Открытые системы в процессе взаимодействия со средой могут достигать так называемого эквифинального состояния, то есть состояния, определяющегося лишь собственной структурой системы и не зависящего от начального состояния среды. Такие открытые системы могут сохранять высокий уровень организованности и развиваться в сторону увеличения порядка и сложности, что является одной из наиболее важных особенностей процессов самоорганизации.
Открытые системы имеют важное значение не только в физике, но и в общей теории систем, биологии, кибернетике,информатике, экономике. Биологические, социальные и экономические системы необходимо рассматривать как открытые, поскольку их связи со средой имеют первостепенное значение при их моделировании и описании.
Эти процессы и системы рассматриваются в неравновесной термодинамике. Аналогично тому как в равновесной термодинамике особым состоянием является состояние равновесия, так в неравновесной термодинамике особую роль играют стационарные состояния. Несмотря на то что в стационарном состоянии необходимые процессы, протекающие в системе (диффузия, теплопроводность и др.), увеличивают энтропию, энтропия системы не изменяет.Представим изменением энтропии DS системы в виде суммы двух слагаемых: DS =DSi + DSl,
где DSi – изменение энтропии, обусловленное необратимыми процессами в системе; DSl – изменение энтропии, вызванное взаимодействием системы с внешними телами (потоки, проходящие через систему). Необратимость процессов приводит к DSi > 0, стационарность состояния – к DSi = 0; следовательно: DSl = DS – DSi < 0. Это означает, что энтропия в продуктах (вещество и энергия), поступающих в систему, меньше энтропии в продуктах, выходящих из системы.
Начальное развитие термодинамики стимулировалось потребностями промышленного производства. На этом этапе (XIX в.) основные достижения заключались в формулировке законов, разработке методов циклов и термодинамических потенциалов применительно к идеализированным процессам.
Биологические объекты являются открытыми термодинамическими системами. Они обмениваются с окружающей средой энергией и веществом. Для организма – стационарной системы – можно записать dS = 0, S = = const, dS i> 0, dSe < 0. Это означает, что большая энтропия должна быть в продуктах выделения, а не в продуктах питания. При некоторых патологических состояниях энтропия биологической системы может возрастать (dS > 0), это связано с отсутствием стационарности, увеличением неупорядоченности. Формула может быть представлена:
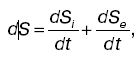 или для стационарного состояния
или для стационарного состояния
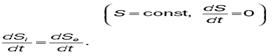
Из этого видно, что при обычном состоянии организма скорость изменения энтропии за счет внутренних процессов равна скорости изменения отрицательной энтропии за счет обмена веществ и энергией с окружающей средой.
Дата добавления: 2016-01-16; просмотров: 1959;
