Растворимость газов в жидкостях и ее зависисмость от природы газа и растворителя, от температуры. Закон Генри. Закон Сеченова. Закон Дальтона.
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты. Поэтому растворимость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономерность часто используют для удаления растворенных газов из воды (например С02 ) кипячением. Иногда растворение газа сопровождается поглощением теплоты (например, растворение благородных газов в некоторых органических растворителях). В этом случае повышение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости беспредельно. При некоторой концентрации газа X устанавливается равновесие:
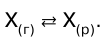
При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому повышение давления согласно принципу Ле Шателье должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малорастворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.): количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
Закон Генри может быть записан в следующей форме:
с (Х) = Kr(X) × P(X)
где – концентрация газа в насыщенном раство–ре, моль/л;
P(X) – давление газа X над раствором, Па;
Kr(X) – постоянная Генри для газа X, моль×л-1 × Па-1 .
Константа Генри зависит от природы газа, растворителя и температуры.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газообразного вещества, а смеси газов, то растворимость каж–дого компонента подчиняется закону Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциаль–ному давлению компонента над жидкостью и не зави–сит от общего давления смеси и индивидуальности других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо подставляют парциальное давление р! данного компонента.
Под парциальным давлением компонента понимают долю давления компонента от общего давления газовой смеси:
Рi/ РобщПарциальное давление компонента рассчитывают по формуле
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Рi = Робщ ×(Xi)
где pi – парциальное давление компонента Хi;Робщ – общее давление газовой смеси;
х(Хi) – молярная доля i-ого компонента.
Дата добавления: 2016-01-16; просмотров: 2141;
