Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии.
Химические реакции часто протекают так, что исходные реагирующие вещества полностью превращаются в продукты реакции. Например, если в соляную кислоту опустить гранулу цинка, то при достаточном количестве кислоты реакция будет продолжаться до полного растворения цинка согласно уравнению:
2НСl+Zn = ZnCl2 + H2
Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми.
К ним откосятся как гетерогенные, так и гомогенные реакции. Например, реакции горения простых веществ — фосфора, угля, железа и сложных — метана СН4, сероуглерода СS2. Как вы знаете, реакции горения относятся к экзотермическим реакциям. Чаще всего к экзотермическим будут относиться реакции соединения, например реакция гашения извести:
СаО + Н2О = Са(ОН)2 + Q (теплота выделяется).
Логично предположить, что к эндотермическим реакциям относятся обратные реакции, то есть реакции разложения, например реакция обжига известняка:
СаС03 = СаО + СО2 - Q (теплота поглощается).
Следует помнить, что очень небольшое число реакций являются необратимыми.
Реакции гомогенные (например, между растворами нешеств) являются необратимыми, если протекают с образованием нерастворимого, газообразного продукта или воды. Это правило называется правилом Еертолле, который и установил это важнейшее условие необратимости химической реакции.
Однако необратимых реакций не так много. Большинство реакций обратимы.
Химические реакции, которые протекают одновременно а двух противоположных направлениях — прямом и обратном — называются обратимыми.
Это процесс можно провести гораздо быстрее, если подо треть раствор угольной кислоты. Следовательно, реакция получения угольной кислоты протекает как в прямом, так н в обратном направлении, то есть является обратимой. Обратимость реакции обозначается двумя противоположно направленными стрелками:
Среди обратимых реакций, лежащих в основе получения важнейших химических продуктов, в качестве примера назо вем реакцию синтеза (соединения) оксида серы (VI) из оксида серы (IV) и кислорода.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени и единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем равновесные концентрации будем обозначать символом вещества в квадратных скобках. Например, равновесные концентарции водорода и аммиака будут обозначаться [Н2] и [NH3].Равновесное парциальное давление будем обозначать индексом р.
Итак, термодинамическим условием химического равновесия является равенство энергии Гиббса химической реакции нулю, т.е. ∆G = 0
13. Константа химического равновесия и способы ее выражения: Кс, Кр, Ка
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями,концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии сзаконом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давлениякомпонентов pi по формуле[1]:
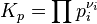
где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры Например, для реакции окисления монооксида углерода:2CO + O2 = 2CO2
константа равновесия может быть рассчитана по уравнению:
 Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
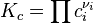 Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
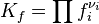
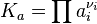
В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента ( 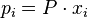 ), тогда легко показать[2], что:
), тогда легко показать[2], что:
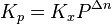 где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (
где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( 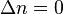 ), то
), то 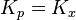 .
.
Стандартная константа равновесия Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии 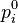 = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
= 0,1013 МПа или 1 атм) может быть рассчитана по выражению:

где 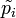 — относительные парциальные давления компонентов,
— относительные парциальные давления компонентов, 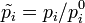 .
.
Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
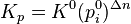
Дата добавления: 2016-01-16; просмотров: 2329;
