Растворимость Н.М.С. в жидкостях. Факторы, влияющие на растворимость. Н.М.С. в жидкостях. Закон распределения Нернста.
Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электриче–ская проводимость растворов неэлектролитов мало отличается от растворителя.
Растворы НМС (электролитов и неэлектролитов) на–зываются истинными в отличие от коллоидных раство–ров. Истинные растворы характеризуются гомоген–ностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Раз–мер растворенных частиц (ионов и молекул) меньше 10-9м.
Нернста закон распределенияопределяет относительное содержание в двух несмешивающихся или ограниченно смешивающихся жидкостях растворимого в них компонента; является одним из законов идеальных разбавленных растворов. Открыт в 1890 В. Нернстом. Согласно Нернста закону распределения, при равновесии отношение концентраций третьего компонента в двух жидких фазах является постоянной величиной. Нернста закон распределения может быть записан в виде c1/c2 = k, где c1 и c2 — равновесные молярные концентрации третьего компонента в первой и второй фазах; постоянная k — коэффициент распределения, зависящий от температуры. Нернста закон распределения позволяет определить более выгодные условия экстрагирования веществ из растворов.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностямивеществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой ( разностью потенциалов ) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 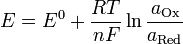 ,
,
где
· 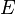 — электродный потенциал,
— электродный потенциал, 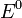 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 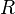 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· 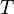 — абсолютная температура;
— абсолютная температура;
· 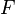 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 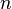 — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе;
· 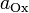 и
и 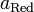 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 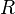 и
и 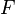 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 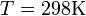 получим
получим
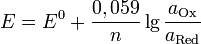
Дата добавления: 2016-01-16; просмотров: 2465;
