Электролитическая диссоциация. Электролиты – вещества, расплавы или растворы в полярных растворителях которых проводят электрический ток
Электролиты – вещества, расплавы или растворы в полярных растворителях которых проводят электрический ток. Причина этого явления состоит в том, что в данных условиях такие вещества распадаются на определенное количество противоположно заряженных частиц – ионов. Процесс распада вещества на ионы под действием температуры или растворителя называется электролитической диссоциацией и является обратимым. Сила электролита определяется степенью электролитической диссоциации α и вычисляется по формуле: 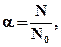 где N – число молекул, распавшихся на ионы; N0 – общее число молекул электролита в растворе; или
где N – число молекул, распавшихся на ионы; N0 – общее число молекул электролита в растворе; или 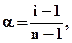 где i – изотонический коэффициент; n – общее число ионов, на которые распадается каждая молекула электролита. Изотонический коэффициент в обобщенном виде учитывает степень отклонения свойств растворов электролитов от законов Рауля и Вант-Гоффа. Например, для растворов электролитов:
где i – изотонический коэффициент; n – общее число ионов, на которые распадается каждая молекула электролита. Изотонический коэффициент в обобщенном виде учитывает степень отклонения свойств растворов электролитов от законов Рауля и Вант-Гоффа. Например, для растворов электролитов:
Δtпл = i·Кк·Сm,
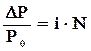 ,
,
Росм=1000i·См·RT.
Более точным критерием для сравнения силы электролита служит константа диссоциации.Это величина, показывающая отношение произведения концентрации ионов к концентрации недиссоциированных молекул слабого электролита в момент равновесия. Например:
HClO ↔ H+ + ClO-
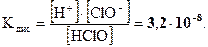
Чем меньше значение константы диссоциации, тем слабее электролит. Для слабых электролитов константа и степень диссоциации находятся в следующей зависимости (закон разбавления Оствальда):
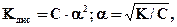
где С – молярная концентрация электролита, моль/л.
Электролиты, практически полностью диссоциирующие в водных растворах, называются сильными. К ним относятся большинство солей, гидроксиды щелочных и щелочно-земельных элементов, некоторые кислоты. Следует иметь в виду, что в случае сильных электролитов найденное таким способом значение α выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциируют полностью.
Пример 1.Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при – 0,23 ºС. Определить кажущуюся степень диссоциации ZnCl2.
Решение. Найдем моляльную концентрацию соли в растворе. Так как молярная масса ZnCl2 равна 136,3 г/моль, то
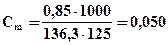 моль на 1000 г Н2О.
моль на 1000 г Н2О.
Теперь определим понижение температуры кристаллизации без учета диссоциации электролита (криоскопическая константа воды равна 1,86):
Δtкрист. выч. = Кк·Сm = 1,86·0,050 = 0,093 ºС.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, вычисляем изотонический коэффициент i:
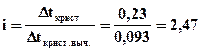 .
.
Теперь находим кажущуюся степень диссоциации соли:
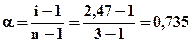 .
.
Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворе. В результате ионы оказываются не вполне свободными в своем движении, и все свойства электролита проявляются слабее, чем следовало бы ожидать при полной диссоциации электролита на не взаимодействующие между собой ионы.
Поэтому для описания состояния ионов в растворе пользуются, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а, моль/дм3, связана с его молярной концентрацией в растворе См соотношением:
а =f· См,
где f – коэффициент активности иона.
В разбавленных растворах коэффициент активности зависит только от заряда иона и ионной силы раствора I, которая равна полусумме произведений концентрации Сi каждого иона на квадрат его заряда zi.: 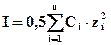 .
.
Приближенно коэффициент активности иона в разбавленном растворе можно вычислить по формуле 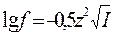
Пример 2.Вычислить ионную силу и активность ионов в растворе, содержащем 0,01 моль/дм3 MgSO4 и 0,01 моль/дм3 MgCl2.
Решение. Ионная сила раствора равна
I =0,5[С(Mg2+)·22 + C(SO42-)·22 + C(Cl-)·12) =0,5(0,02·4+ 0,01·4+ 0,02)= 0,07.
Коэффициент активности иона Mg2+(и равный ему коэффициент активности иона SO42-) найдем по формуле
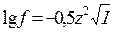 =
= 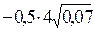 = -0,53, откуда f = 0,30.
= -0,53, откуда f = 0,30.
Аналогично находим коэффициент активности иона Cl-6
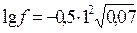 =-0,13, откуда f = 0,74.
=-0,13, откуда f = 0,74.
Теперь, пользуясь соотношением а =f· См, находим активность каждого иона: а(Mg2+) = 0,02·0,30 = 0,006 моль/дм3; а(SO42-) = 0,01·0,30 = 0,003 моль/дм3; а(Cl-) = 0,02·0,74 = 0,0148 моль/дм3;
Дата добавления: 2016-01-09; просмотров: 764;
