ИОНООБМЕННЫЕ РЕАКЦИИ. ГИДРОЛИЗ СОЛЕЙ
При взаимодействии растворов электролитов реакции происходят между ионами растворенных веществ. Химический процесс можно записать в молекулярной и ионно-молекулярной формах. Однако ионная форма отражает его точнее. При составлении ионных уравнений реакций вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные изображаются в виде молекул.
Пример 1.Записать в молекулярной и ионно-молекулярной формах уравнения реакций между следующими веществами: H2SO4 и BaCl2; Na2СО3 и НCl.
Решение:
1) H2SO4 + BaCl2= Ва SO4 ↓+ 2 НCl – молекулярное уравнение,
2Н + + SO4 2-_+ Ва2+ + 2Cl- = ВаSO4 ↓ + 2Н+ + 2Cl- – полное ионно-молекулярное уравнение;
Ва2+ + SO4 2- = ВаSO4 ↓ – сокращенное ионно-молекулярное уравнение.
Сокращенное ионно-молекулярное уравнение показывает, что в реакции участвуют только ионы Ва2+ и SO4 2-.
2) Na2СО3 + 2НCl = 2NaCl + Н2О + СО2↑
2 Na + + СО3 2-_+ 2Н++ 2Cl- = 2 Na + + 2Cl- + Н2О + СО2↑
СО3 2-_+ 2Н+ = Н2О + СО2↑
Гидролизомназывается взаимодействие солей и воды с образованием слабодиссоциирующих веществ, одновременно сопровождающееся смещением ионного равновесия воды. Отсюда следует, что не всякое взаимодействие соли с водой является гидролизом, а следовательно, не все соли гидролизу подвергаются.
Гидролизу подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (Na2CO3, CH3COOK), катионом слабого основания и анионом сильной кислоты ( ZnCl2, Al2(SO4)3), катионом слабого основания и анионом слабой кислоты (CH3COONH4, Al2S3).
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
При анализе состава солей нужно помнить, что:
| 1. К сильным основаниям относятся: LiOH, KOH, NaOH, CsOH, RbOH, Ca(OH)2, Ba(OH)2, Sr(OH)2, Rа(OH)2. 2. К сильным кислотам относятся: H2SO4, H2SеO4, HNO3, HClO4, HBr, HI, HCl. | 3. Слабые основания образуют катионы всех остальных металлов и NH4+. 4. К слабым кислотам относятся: H2SO3, HNO2, HClO, HF, H3PO3, H2CO3, H2S, H2SiO3,CH3COOH и др. |
Соли, образованные многокислотными основаниями или многоосновными кислотами, подвергаются ступенчатому гидролизу. Более легко протекает первая ступень гидролиза, и на ней, как правило, при обычных условиях гидролиз солей завершается. Скорость гидролиза зависит от растворимости солей, оснований и кислот, поэтому необходимо учитывать этот фактор (прил. 7).
Гидролизу подвергается не все количество находящейся в растворе соли, а только часть ее. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, - степень гидролиза, - зависит от константы этого равновесия, а также от температуры и концентрации соли.
Запишем уравнение гидролиза в общем виде. Пусть НА – кислота, МОН – основание, МА – образованная ими соль. Тогда уравнение гидролиза будет иметь вид:
МА + Н2О ↔НА + МОН
Этому равновесию отвечает константа
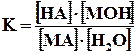 .
.
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К·[ Н2О] =Кг, получим
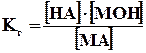 .
.
Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз. Для соли, образованной катионом сильного основания и анионом слабой кислоты, константа гидролиза связана с константой диссоциации кислоты Ккисл зависимостью:


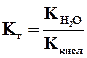 .
.
Это уравнение показывает, что Кг тем больше, чем меньше Ккисл . Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
Для солей, образованных катионом слабого основания и анионом сильной кислоты, аналогичное выражение связывает константу гидролиза с константой диссоциации основания Косн:
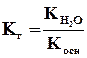 .
.
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза.
Зависимость степени гидролиза (h) от концентрации выражается через закон разбавления:
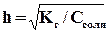 ,
,
то есть с разбавлением раствора степень гидролиза увеличивается.
Влияние температуры на степень гидролиза вытекает из принципа Ле-Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением теплоты. Поскольку выход эндотермических реакций с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
Пример 1.Составить молекулярное и ионное уравнение гидролиза соликарбоната натрия.
Решение. Соль Na2СO3 образована сильным основанием (NaOH) и слабой кислотой (H2СO3), таким образом,гидролиз соли будет протекать по аниону. Так как ион СO32- содержит 2 заряда, то гидролиз возможен в 2 ступени: первая ступень протекает в обычных условиях, вторая – при нагревании или разбавлении. Рассмотрим гидролиз по первой ступени:
Сокращенное ионное уравнение гидролиза:
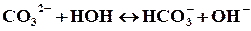
полное ионное уравнение гидролиза:
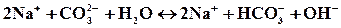
молекулярное уравнение:
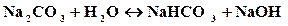
Так как в растворе накапливаются гидроксид-ионы, то среда щелочная, т.е. рН>7.
Пример 2. Составить молекулярное и ионное уравнение гидролиза соли хлорида алюминия.
Решение.Гидролиз солей, образованных слабым основанием (Al(OH)3) и сильной кислотой (HCl) протекает по катиону:

В обычных условиях гидролиз протекает по первой ступени, незначительно – по второй. Третья ступень практически не протекает, однако разбавление или нагревание усиливают гидролиз.
Первая ступень:
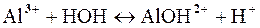
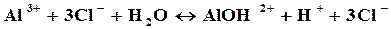
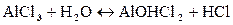
Так как в растворе накапливаются ионы водорода, то среда кислая, т.е. рН<7.
Пример 3. Составить молекулярное и ионное уравнение гидролиза соли, образованной слабым основанием и слабой кислотой.
Решение.Гидролиз солей, образованных слабым основанием и слабой кислотой, протекает полностью и с достаточно большой скоростью, например:
Al2 (CO3)3+3Н2О=2Al(OH)3+3CO2 .
Подобный процесс наблюдается при смешивании растворов Na2CO3 и AlCl3, в которых соответственно имеются избыток ионов ОН- и Н+:

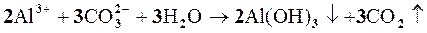
Задачи к главе 9
Й уровень
336-340. Записать в молекулярной и ионно-молекулярной формах уравнения реакций между веществами А и Б, приводящих к образованию малорастворимых осадков или газов:
| Задачи | |||||
| А | NiСl2 | К2СО3 | СuSO4 | Рb(NО3)2 | АgNО3 |
| Б | Н2S | Н2SО4 | Na3РО4 | KI | AlBr3 |
341-345. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах. Укажите, каким будет рН их растворов (рН>7, рН<7, рН=7):
| Задачи | |||||
| А | NiSО4 | СоСl2 | Аl2(SO4)3 | Zn(NО3)2 | АgNО3 |
| Б | К2СО3 | НСООNа | Na3РО4 | Li3ВО3 | KIO |
346-350. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах. Запишите уравнение совместного гидролиза этих солей в молекулярной форме, если одним из продуктов совместного гидролиза является гидроксид металла соли А:
| Задачи Задачи | |||||
| A | SnSO4 | CrCl3 | Zn(NO3)2 | АlСl3 | Gа2(SО4)3 |
| Б | K2S | K2CO3 | СН3СООNа НСООNа Li2CO3 | Nа2Sе | Nа2СО3 |
351-355. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах. Укажите, каким будет рН их растворов (рН>7, рН<7, рН=7):
| Задачи | |||||
| А | FеСl2 | Nа2S | Sn(NО3)2 | Nа2SеО3 | КСlО |
| Б | FеСl3 | Nа2SO3 | Sn(NО3)4 | Nа2SеО4 | КIО |
Й уровень
356-360. Составьте уравнения гидролиза солей А и Б в молекулярной и ионно-молекулярной формах и укажите, как изменится (уменьшится или увеличится) степень гидролиза этой соли при: а) при уменьшении ее концентрации; б) уменьшении рН; в) увеличении температуры, учитывая, что реакция гидролиза является эндотермической?
| Задачи | |||||
| A | V2(SО4)3 | Na3ВО3 | Тi(SО4)2 | КВrО | SnCl4 |
| Б | NiSО4 | СоСl2 | Аl2(SO4)3 | Zn(NО3)2 | АgNО3 |
361-365. Укажите направление смещения равновесия гидролиза соли А при добавлении к раствору веществ Б, В и Г:
| Задачи | |||||
| А | МnСl2 | КАsО2 | СоSО4 | SbСl3 | NаРО2 |
| Б | НСl | НNO3 | Н2SО4 | НСl | НNО3 |
| В | КОН | NаОН | КОН | RbОН | КОН |
| Г | NаСl | LiNO3 | Nа2SО4 | КСl | NаNО3 |
366-370. Какое из веществ Б, В или Г следует добавить к раствору соли А, чтобы степень гидролиза увеличилась?
| Задачи | |||||
| А | Nа2SeО3 | Li2S | Pb(NO3)2 | СоSО4 | SbСl3 |
| Б | НСl | НNО3 | Н2SО4 | НNО3 | НСl |
| В | КОН | NаОН | КОН | NаОН | NаОН |
| Г | NаNО3 | K2SО4 | K2SО4 | КNО3 | KF |
Й уровень
371-375. Записать в молекулярной и ионно-молекулярной формах уравнения реакций между водными растворами следующих веществ:
| Задачи | |||||
| А | Са(ОН)2 | Са(ОН)2 | Аl(NО3)3 | Zn (NО3)2 | SnCl2 |
| Б | СО2(изб.) | СО2 | КОН(изб.) | КОН(изб.) | КОН(изб.) |
Для каждого случая указать причину смещения равновесия в сторону прямой реакции.
376-380.Значение рН 0,1 М раствора соли А составляет В. Рассчитайте константу Кг и степень гидролиза h. Составьте уравнение гидролиза в ионно-молекулярной форме. По вычисленным значениям Кг и h мотивированно укажите, к продуктам или к исходным веществам смещено равновесие гидролиза:
| Задачи | |||||
| А | Аl(NО3)3 | CdSO4 | Nа2SО3 | КВrО | GаСl3 |
| B |
381-385.Вычислите рН водного раствора А с концентрацией с, моль/л, если степень диссоциации α = 0,8:
| Задачи | |||||
| А | Ва(ОН)2 | NaОН | НNO3 | НВr | НСlО4 |
| с, моль/л | 0,1 | 0,01 | 0,001 | 0,05 | 0,1 |
Дата добавления: 2016-01-09; просмотров: 2302;
