Как выражается константа гидролиза для различных случаев гидролиза? Что называется константой гидролиза? От чего зависит константа гидролиза соли?
Константа гидролиза естьконстанта равновесия процесса гидролиза
Если представить уравнение гидролиза в общем виде:
МА + Н2О « HА + МОН, где МА - соль;
НА - кислота;
МОН - основание,
то константа равновесия этой реакции будет следующая:
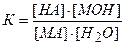 . (5.14)
. (5.14)
Концентрация воды в разбавленном растворе и константа равновесия этого процесса — величины постоянные. Произведение двух постоянных величин будет также величиной постоянной: К[Н2О]=Кг - это и будет константа гидролиза. Константа гидролиза для данной реакции равна:
 (5.15)
(5.15)
Физический смысл константы гидролиза заключается в том, что она характеризует способность данной соли подвергаться гидролизу. Чем больше Кг,, тем в большей степени протекает гидролиз.
Кг зависит от природы соли и температуры.
Рассмотрим случаи зависимости Кг от природы соли.
1. Соль образована слабой кислотой и сильным основанием:
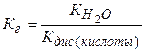 (5.16)
(5.16)
Уравнение (5.16) показывает, что константа гидролиза Кг тем больше, чем меньше Кдис(кислоты)), т. е. чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
2. Соль образована слабым основанием и сильной кислотой.
В этом случае К, зависит от степени диссоциации основания:
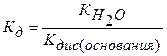 (5.17)
(5.17)
Чем слабее основание, тем в большей степени подвергается гидролизу образованная им соль.
3. Случай, когда соль образована слабым основанием и слабой кислотой.
Для таких солей Кг будет зависеть как от Кдис(кислоты), так и от Кдис(основания).
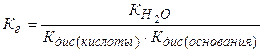 . (5.18)
. (5.18)
Из выражения (5.18) видно, что чем слабее основание и кислота, тем в большей степени протекает гидролиз соли.
Константа гидролиза связана со степенью гидролиза следующей зависимостью:
 . (5.19, а)
. (5.19, а)
Откуда
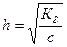 (5.19,б)
(5.19,б)
где h - степень гидролиза;
с - концентрация раствора соли, моль/дм3.
Если соль образована двухосновной кислотой, т. е. гидролиз двухступенчатый, то тогда константы гидролиза соответственно будут равны:
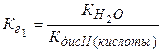 ;
;  (5.20)
(5.20)
где КдисII(кислоты) и КдисI(кислоты) – константы диссоциации кислоты по II и I ступеням.
Зная степень гидролиза и концентрацию раствора соли, можно определить рН раствора:
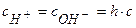 . (5.21)
. (5.21)
Используя выражения (5.12) и (5.21), получаем:
pH = -lg(h× c).
Дата добавления: 2015-12-26; просмотров: 3265;
