Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
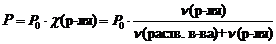 ,
,
где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c(р-ля) – мольная доля растворителя;
n(раств. в-ва) – количество растворенного вещества, моль;
n(р-ля) – количество вещества растворителя, моль.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
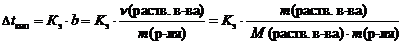
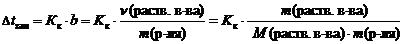 ,
,
где Dtкип – повышение температуры кипения раствора, °С;
Dtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;
Кк – криоскопическая константы растворителя, (кг×°С)/моль;
b – моляльная концентрация, моль/кг;
n(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов:
tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
Дата добавления: 2015-12-26; просмотров: 8826;
