Что такое константа скорости химической реакции?
От каких факторов она зависит?Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.Константа скорости реакции зависит от температуры, от природы реагирующих веществ, от катализатора, но не зависит от их концентрации. Для реакции вида 2А+2В->3C+D скорость образования продуктов реакции и скорость расходования реагентов могут быть представлены как: d[A]/(2*dt)=d[B]/(2*dt)=d[C]/(3*dt)=d[D]/dt Таким образом, чтобы избежать использования нескольких форм записи скорости для одной и той же реакции используют химическую переменную, которая определяет степень протекания реакции и не зависит от стехиометрических коэффициентов: ξ=(Δn)/ν где ν - стехиометрический коэффициент. Тогда скорость реакции: v=(1/V)*dξ/dt где V - объем системы.
57.Как зависит скорость хим.реакции от температуры?Правило Вант-Гоффа,Уравнение Аррениуса.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:
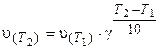
где v(T2) и v(T1) - скорости реакций, соответственно при температурах Т2 и T1 (T2> T1);
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:
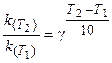
где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
γ -температурный коэффициент скорости реакции.
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем
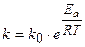 ,
,
где k - константа скорости реакции;
k0 - предэксноненциальный множитель;
е - основание натурального логарифма;
Ea - постоянная, называемая энергией активации, определяемая природой реагентов:
R-универсальная газовая постоянная, равная 8,314 Дж/моль×К.
Значения Еa для химических реакций лежат в пределах 4 - 400 кДж/моль.
Многие реакции характеризуются определенным энергети-ческим барьером. Для его преодоления необходима энергия актации - некоторая избыточная энергия (по сравнению со вредней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового ве-щества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение (3.9) после логарифмирования примет вид:
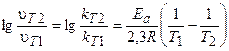 .
.
Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
Скорость химических реакций возрастает в присутствии катализатора. Действие катализатора заключается в том, что он образует с реагентами неустойчивые промежуточные соединения (активированные комплексы), распад которых приводит к. образованию продуктов реакции. При этом энергия активации, понижается, и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие, катализатора. В результате возрастает общее число активных£ молекул и увеличивается скорость реакции.
Изменение скорости реакции в присутствии катализатора выражается следующим уравнением:
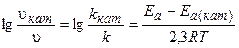 ,
,
где vкат, и Ea(кат) - скорость и энергия активации химической реакции в присутствии катализатора;
v и Еа - скорость и энергия активации химической реакции без катализатора..
Дата добавления: 2015-12-26; просмотров: 3766;
