При увеличении температуры увеличиваются скорости как прямой,так и обратной реакции.Почему наблюдается смещение равновесия?Изменяется ли при этом константа хим.равновесия?
При изменении температуры изменяются скорости как прямой, так и обратной реакций, однако, изменение скоростей происходит не в одинаковой степени. В соответствии с уравнением Аррениуса в большей степени на изменение температуры реагирует эндотермическая реакция, характеризующаяся большим значением энергии активации. Следовательно, для оценки влияния температуры на направление смещения химического равновесия необходимо знать тепловой эффект процесса. Его можно определить экспериментально, например, с помощью калориметра, или рассчитать на основе закона Г. Гесса. Следует отметить, что изменение температуры приводит к изменению величины константы химического равновесия (Kp).
Согласно принципу Ле Шателье повышение температуры смещает равновесие в сторону эндотермической реакции. При понижении температуры равновесие смещается в направлении экзотермической реакции.
| 64) Что такое адсорбция? Какие причины обуславливают адсорбционную способность вещества? Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция.По адсорбционной теории Лангмюраа.с.в характеризуется полным содержанием адсорбированного вещества в поверхностном слое, а не избытком , как в теории Гиббса .Выражена тем сильнее, чем большей общей поверхностью обладает данное вещество. В то же время весьма малые размеры отдельных частиц, составляющих коллоидный раствор ( дисперсной фазы), обусловливают их очень большую общую поверхность. Принцип хроматографического метода разделения основан на различии вадсорбционной способности веществ, которая зависит как от природы адсорбируемых веществ, так и от природы адсорбентов. Различные вещества на одном и том же адсорбенте адсорбируются в разной степени. Это можно представить и таким образом, что при адсорбционном равновесии они неодинаковое время находятся на поверхности адсою рбента. Вещество, которое адсорбируется сильнее, дольше удерживается на поверхности адсорбента. Если смесь газов или жидкий раствор пропускать через слой адсорбента - хроматографическую колонку, то из нее раньше будут выходить компоненты, которые сорбируются слабее. |
| 65)Что такое адсорбент, адсорбат? В чем суть процесса адсорбции? Чем понятие абсорбция отличается от понятия адсорбция? Адсорбенты – это вещества, обладающие способностью адсорбции , т. е. поглощения, всасывания какого-либо другого вещества из раствора или из газа только своей поверхностью, в отличие от абсорбентов, которые поглощают, всасывают всей своей массой. Адсорбат вещество, адсорбированное на поверхности раздела фаз.Абсо́рбция —поглощение сорбата всем объёмом сорбента. Является частным случаем сорбции. |
| 66)Что такое адсорбция и десорбция? Как количественно выражают адсорбцию? Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Десорбция физ. хим. процесс, обратный адсорбции, то есть удаление адсорбированного вещества с поверхности адсорбента (с поверхности раздела фаз) и перенос его в окружающую среду. Количественное выражение адсорбции – абсолютная адсорбция кол-во в-ва(моль) в поверхностном слое, приходящееся на единицу площади поверхности или единицу массы адсорбента. Гиббовская адсорбция – избыточное число моль адсорбата в поверхностном слое (на единицу площади поверхности) по сравнению с тем числом моль, который бы находился в адсорбционном объеме в отсутствии адсорбции. |
| 67)что такое адсорбционное равновесие и чем оно характеризуется? Как можно сместить адсорбционное равновесие? Адсорбционное равновесие представляет собой динамическое ( подвижное) равновесие. Как и всякое подвижное равновесие, зависит от условий процесса, а именно от температуры и от концентрации адсорбтива. Наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции. В системе устанавливается в течение от долей секунды для газов, до нескольких часов для растворов. характеризуется константой К уравнения, если адсорбция происходит из газовой фазы, и константой Ь уравнения. В некоторых случаях смещение адсорбционного равновесия имеет место в результате происходящих на поверхности вторичных процессов. Одним нз них может быть растворение адсорбированного вещества в поглотителе, т. е. переход его с поверхности внутрь последнего (абсорбция). При этом поверхность освобождается и может адсорбировать новые порции поглощаемого вещества. Именно так, по-виднмому, протекает поглощение водорода металлическим палладием. Рассматриваемые в совокупности процессы адсорбции и абсорбции иосят общее название сорбции. Другим фактором, смещающим адсорбционное равновесие, являются химические реакции на поверхности. Последние могут протекать как между различными одновременно адсорбированными веществами, так и между адсорбированным веществом и самим поглотителем |
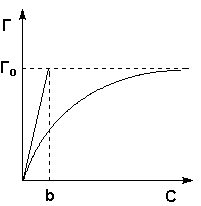
| 68)Зависимость количества адсорбированного вещества Г от температуры при постоянном давлении для физ. и хим. адсорбции. Зависимость количества адсорбированного вещества ( ПАВ) от равновесного давления ( или концентрации) при постоянной температуре, т.е. графики а f ( p) или о - f ( c) при Т const, называются изотермами адсорбции.Изотерма адсорбции — зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре. |
| 69)Как поверхностная активность вещества зависит от его молярной массы в пределах гомологического ряда? Дляповерхностной активности вещества очень существенным является расположение этих групп в молекуле. Молекулы поверхностно-активных веществ адсорбируются тем сильнее, чем резче выражена асимметричность расположения в них гидрофильных и гидрофобных групп. Согласно правилу Траубеповерхностная активность веществ в пределах одного гомологического ряда возрастает при переходе от одного члена ряда к другому. |
| 70)Дайте формулировку правила Дюкле-Траубе. зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза |
71 Теория мономолекулярной адсорбции Ленгмюра.
Теория мономолекулярной адсорбции, которую разработал американский химикИ. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
Дата добавления: 2015-12-26; просмотров: 6552;
