Классификация дисперсных систем по агрегатному состоянию фаз , их виды и обозначения .?
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсная фаза | Дисперсионная среда | Название и пример |
| Г/Г | Газообразная | Газообразная | Не образуют дисперсные системы |
| Ж/Г | Жидкая | Газообразная | Аэрозоли: туманы, облака |
| Т/Г | Твёрдая | Газообразная | Аэрозоли (пыли, дымы), порошки |
| Г/Ж | Газообразная | Жидкая | Газовые эмульсии и пены |
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем, молоко |
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Т | Газообразная | Твёрдая | Пористые тела: поролон, пемза |
| Ж/Т | Жидкая | Твёрдая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы |
78-79
По размерам частиц дисперсные системы делят на три типа: 1. Грубодисперсные системы (суспензии, эмульсии, порошки, грубые взвеси) – размер ча-стиц больше 1 мкм (10 –6 м), а удельная поверхность меньше 1м 2 /г; 2. Системы средней дисперсности – частицы 1 – 0,1 мкм (10 –6 – 10 –7 м); Иногда их объединя-ют с грубодисперсными системами. 3. Коллоидно–дисперсные системы (или золи) имеют размер частиц 100 – 1 нм (10 –7 – 10 –9 м), а удельную поверхность больше 10 м 2 /г. Далее идут истинные (молекулярные и ионные) растворы, которые имеют размер частиц ме-нее 10 –9 м. Здесь уже нет поверхности раздела фаз и их неотносят кдисперсным системам. Таблица1. Отличиядисперсныхсистем и растворов Грубодисперсные системы Коллоидные системы Истинные растворы Непрозрачные Прозрачные,опалесциируют Прозрачные, неопалесциируют Имеют поверхность раздела Имеют поверхность раздела Не имеют поверхности раздела фаз фаз фаз Частицы не проходят через Частицы проходят через бу- Частицы проходят черезбумаж- бумажный фильтр мажный фильтр, нозадержива- ный фильтр и целлофан ются целлофаном Нестойкиекинетически и Относительностойкиекинети- Стойкиекинетически и термоди- термодинамически чески намически Современем стареют Современем стареют Современем не стареют Частицы видны воптический Частицы видны вэлектронный Частицы невидны всовремен- микроскоп микроскоп ных микроскопах
80
В зависимости от агрегатногосостояниядисперсной фазы и дисперсной среды гете- рогенные системы делят на твердые, жидкие, газообразные (таблица2). Таблица2. Типы гетерогенныхсистем Дисперсная Дисперсная среда Сокращенное Примеры систем фаза (растворитель) обозначение Жидкость Газ ж/г Туманы,аэрозоли жидкихвеществ Твердое тело Газ т/г Дымы,аэрозоли твердыхвеществ Газ Жидкость г/ж Пены, газовые эмульсии Жидкость Жидкость ж/ж Эмульсии (молоко) Твердое тело Жидкость т/ж Суспензии и коллоидные растворы Газ Твердое тело г/т Твердые пены, пемза,активные угли Жидкость Твердое тело ж/т Гели, студни Твердое тело Твердое тело т/т Сплавы металлов, природные минералы По типу взаимодействиядисперсной фазы и дисперсной среды различают:2 Лиофильные системы – в которых дисперсные частицы сильно взаимодействуют с растворителем. В случаях, когда растворителем является вода, их можно назвать гидрофиль-ными системами. Например – растворы белков или полисахаридоввводе; Лиофобные системы – в которых частицы слабо взаимодействуют с растворителем. Если растворителем является вода, системы называют гидрофобными, так как поверхность частиц слабо смачивается водой. Примеры – коллоидные растворы благородных металлов
. 81-83
Условия и способы полученияколлоидных растворов. Термин “коллоидный” раствор предложил Томас Грем (от латинского слова cоlа – клей), ко-торый заметил их сходство с растворами клеящих веществ. Коллоидные растворы занимают промежуточное место между грубодисперсными системами и истинными растворами. Для приготовления коллоидных растворов необходимо придерживаться определенныхусловий: 1. Размеры частиц должны бытьв пределах10 –7 – 10 – 9 м. 2. Необходимы ионы электролитов, которые образуют ионный слой вокруг коллоидной ча-стицы, придавая ей стабильность. 3. Дисперсная фазагидрофобныхколлоидных растворовдолжна иметь низкую раствори-мостьвводе. Различают 2 группы методов получения коллоидных растворов: Дисперсионный ме-тод заключается в измельчении вещества до мелких частиц: 1) механическим способом (ша-ровые мельницы, гомогенизаторы, ультразвуковые дезинтеграторы); 2) физико-химическим способом – метод пептизации, когда осадок вещества переводиться в коллоидное состояние добавлением поверхностно–активных соединений - мыла, белков. Пептизацией называют переход осадков в коллоидный раствор под действием специальных стабилизирующих добавок (пептизаторов), либо за счет удаления из системы ионов, способствующих агрегации частиц. В роли пептизаторов могут выступать раствор электролита, поверхностно-активного вещества или растворитель. Пептизировать можно только свежеприготовленные осадки, в которых частицы коллоидного размера соединены в более крупные агрегаты через прослойки ДС. По мере хранения осадков происходят явления рекристаллизации и старения, приводящие к сращиванию частиц друг с другом, что препятствует пептизации. Пептизацию относят к методам диспергирования условно, т. к. в ее основе лежит и метод конденсации, т. е. предварительное получение агрегатов из истинных растворов. Метод пептизации, в отличие от другихдиспергационных методов, позволяет также добиться получения коллоидных систем с малым размером частиц (до1 нм),чтохарактерновосновном для методовконденсации. Конденсационный метод направлен на увеличение размеров частиц путем агрегации молекул или ионов. Для этого используют: 1) испарение растворителя, вследствиечего идет конденсация твердой фазы; 2) замена растворителя, например, если спиртовой раствор холе-стеринавылитьвводу; 3) использование реакций, в которых осадки формируются из мелких частиц. Так, получение коллоидного раствора йодидасеребра идет по реакции замещения: + KNO3¯ AgJ ®KJ + AgNO3 Коллоидные растворы можно получатьв реакцияхвосстановления,окисления и гидролиза: + H2O¯ 2Ag®Ag2O + H2 +2Н2О¯ 3 S®2 H2S+SO2 +3 HCl. 3¯ Fe(OH)3®FeCl3 +3H2O
84
Строениеколлоидныхчастиц Считают, что коллоидный раствор состоит из мицелл, которые образуются заряженны-ми коллоидными частицами. Зарядвозникает вследствие избирательной адсорбции ионов на поверхности частиц, или засчет ионизации поверхностных функциональных групп твердой фазы. В мицелле различают три составных части: ядро, адсорбционный слой ионов и диф-фузионный слой ионов. Ядро составляет основную массу мицеллы и является совокупно-стью нейтральных атомов или молекул, общим числом сотни и миллионы единиц. На ядре адсорбируются ионы (избирательная адсорбция) которые придают ему определенный заряд, поэтому их называют потенциалообразующими. Потенциал, возникающий на ядре, получил еще название электротермодинамического и он обуславливает дальнейшее присоединение к потенциал-образующим ионам некоторого количества других ионов с противоположным знаком заряда. Такой двойной электрический слой, потенциало-образующих ионов, вместе с противоионами (ионами з противоположным знаком) составляет адсорбционный слой ионов. Часть противоионов слабо связана с потенциало- образующими ионами и свободно переме-щается в растворителе, формируя диффузионный слой. Ядро вместе с адсорбционным и диф-фузионным слоями ионов и составляет мицеллу, которая в целом является электронейтраль-ной (тогдакаксамаколлоиднаячастица несет определенный заряд). Рассмотрим строение мицеллы йодидасеребра,котораяобразуетсяв реакции:4 ¯ KNO3 + AgI®AgNO3 + KI Возможны два варианта образования мицеллы. 1. В растворе есть избыток йодид-анионов (т.е. к раствору KI по каплям добавляют раствор нитрата серебра). Ядро мицеллы образуется из выпадающего в осадок малорастворимого йодида серебра AgI. На его поверх-ности начинают, в соответствии с правилом избирательной адсорбции сорбироваться йодид-ионы (I - ), которые находятся в избытке и которые могут пойти на достройку ядра. Они обра-зуют отрицательный заряд ядра и являются потенциало- образующими. К этому слою присо-единяются положительно заряженные ионы калия (К + ), которые образуют адсорбционный слой ионов и противоионов. Часть ионов калия слабо связанасядром и может диссоцииро-вать, формируядиффузионный слой ионов. Строение мицеллы будет следующим: {[AgI]m ∙nI – (n – x)K + } x– ∙xK + где в фигурных скобках изображена гранула мицеллы (коллоидная частица), которая состоит из агрегата m∙[AgI], к которому присоединяются потенциало-образующие ионы n∙I – , с об-разованием заряженного ядра m∙[AgI]∙n∙I – , к которому присоединяются противоионы (n– x)∙K + с формированием адсорбционного слоя ионов n I – ∙(n–x)∙K + } –x в виде двойного электрического слоя,что придает заряд коллоидной частице, нейтрализациякоторого идет засчет диффузионного слоя ионовxK + , поэтому мицеллав целом электронейтральна. 2. В растворе избыток ионов серебра (к раствору нитрата серебра добавляют по кап-лям раствор йодида калия). В этом случае образуется мицелла с противоположным знаком потенциал-образующего иона. Строение мицеллы такое: { [AgI]m∙nAg + (n–x)NO3 - } x+ xNO3 - ) илиVНаличие поверхности раздела фаз между адсорбционным и диффузионным слоями ми-целлы обуславливает возникновение дзета–потенциала ( электрокинетического потен-циала. Он представляет разницу между общим зарядом потенциало-образующих ионов и за-рядом противоионов, находящихся в адсорбционном слое. -потенциал имеет нулевое значение, а мицелла находится в изоэлектрическом состоянии.VЕсли общий заряд потенциально-образующих ионов равняется заряду противоионов, то Электрокинетический потенциал изме-ряют по скорости движениягранулы коллоидной частицы при электрофорезе: ∙He∙V V =-------- , h∙p4∙ - вязкость среды; Н - напряженность электрического поля; V – скоростьдвижениячастицы вэлектрическомh - диэлектрическая проницаемость среды; e - дзета–потенциал; Vгде поле Заряженными являются не толькоколлоидныечастицы, но и все живыеклетки, причем поверхность их несет отрицательный заряд (имеет отрицательный электрокинетический по-тенциал). Все биологические жидкости являются коллоидными растворами, так как присутствую-щие в них малорастворимые вещества (холестерин, триглицериды, жирные кислоты и др.) могут поддерживаться в взвешенном состоянии только благодаря стабилизации. Нарушение стойкости коллоидов желчи и мочи ведет к образованию камней, снижение стойкости колло-идных систем крови ведет к отложению холестерина и липидов в сосудах. Чаще всего потеря стабильности коллоидных биологических жидкостей является следствием недостаточного количества белков, которые стабилизируют частицы липидов и других веществ, или (что чаще) - следствием качественных изменений в этих белках. В организме существуют процес-сы, которые напоминают процессы коагуляции колодных растворов. Например, переход кро-ви из жидкого состояния в твердое носит названиекоагуляции (свертывания) крови
85.Правило Панета-Фаянса. Структура дэс. Принципы его формирования
Правило Фаянса — Панета — правило, эмпирически установленное
К.Фаянсом и Ф.Панетом (1913),согласно которому
радиоактивный изотоп, присутствующий в растворе в
микроконцентрациях в формекатиона, тем сильнее сорбируется
выпадающим или заранее полученным осадком, чем меньше
растворимость соединения, которое образует этот катион с анионом
осадка. Правило Фаянса — Панетаприменимо при соосаждении в радиохимии.
Иная формулировка этого правила (также называемая правилом
Фаянса — Пескова Панета) гласит отом, что на поверхности твердого
вещества преимущественно адсорбируются ионы, которые могут
достраивать кристаллическую решетку , то есть входят в ее состав,
изоморфны или образуюттруднорастворимое соединение с ионами,
составляющими кристаллическую решетку. Эта формулировка
применяется для определении знака заряда поверхности
при образовании ДЭС в коллоидной химии.[1]
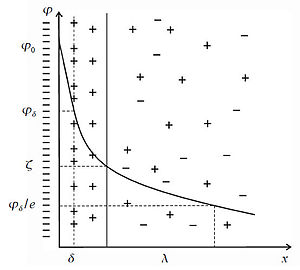
В отсутствие теплового движения частиц строение двойного электрического слоя было бы
подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в
реальных условиях имеет диффузное (размытое) строение. Согласно современной
теории структуру ДЭС составляют два слоя: Слой Гельмгольца или адсорбционный
слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет
толщину δ, равную радиусу потенциалопределяющих ионов внесольватированном состоянии.
Диффузный слой или слой Гуи, в котором находятся противоионы.
Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать
больших значений. Толщина диффузного слоя рассчитывается по формуле:
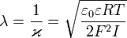
Дата добавления: 2015-12-26; просмотров: 2703;
