ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Вода является слабым электролитом и диссоциирует по уравнению
Н2О↔ Н+ + ОН-
Константа диссоциации воды весьма мала и составляет при 25ºC:

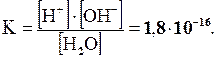
Принимая концентрацию воды [Н2О] величиной практически постоянной и учитывая, что молярная концентрация воды в воде равна 1000/18 =
=55,56 моль/л, получаем
[Н+] ·[ОН-] = 1·10-14 = Кн2о.
Произведение концентрации ионов водорода и гидроксила называется ионным произведением воды. Поскольку диссоциация воды – эндотермический процесс, то с ростом температуры она увеличивается, и значение Кн2о возрастает.
Так как при диссоциации одной молекулы воды получается один ион водорода и один ион гидроксила, то в чистой воде [Н+] = [ОН-] = 10-7моль/л (при 25ºC). Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными.
Если к воде прибавить кислоту, то [Н+]>10-7моль/л; а если прибавить щелочь, то [Н+]<10-7моль/л.
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком.
Отрицательный десятичный логарифм концентрации водородных ионов принято называть водородным показателем рН:
рН = -lg[Н+].
Тогда рН различных растворов будут иметь следующие значения: кислый рН < 7, нейтральный рН=7, щелочной рН > 7.
Отрицательный десятичный логарифм концентрации гидроксид-ионов принято называть гидроксильным показателем рОН:
рОН = -lg[ОН-].
При 25ºC рН + рОН = 14.
Пример 1.Концентрация ионов водорода в растворе равна
4·10-4 моль/дм3. Определить рН раствора.
Решение. Округляя значение логарифма до 0,01, получим
рН = -lg [4·10-4] = - (-2,40) = 2,40.
Пример 2.Чему равнаконцентрация гидроксид-ионов в растворе, рН которого равен 10,80?
Решение. Из соотношения рН + рОН = 14, находим: рОН = 14-рН =14-10,80 = 3,20. Отсюда lg [ОН-] =- 3,20. Этому значению логарифма соответствует значение [ОН-] =6,31·10-4 моль/дм3.
Задачи к главе 8
Й уровень
321-325. Найти концентрацию ионов Н+ в растворах, в которых концентрация гидроксид-ионов составляет А:
| Задачи | |||||
| А, моль/дм3 | 10-4 | 3,2·10-6 | 7,4·10-11 | 9,3·10-9 | 5·10-8 |
Й уровень
326-330. Определить [Н+] и [ОН-] в растворе, рН которого равен А:
| Задачи | |||||
| А |
Й уровень
331. Рассчитать рН раствора, полученного смешением 25 см3 0,5М раствора НСl, 10 см3 0,5М раствора NaOΗ и 15 см3воды.
332. Рассчитать рН 0,1н раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/дм3СН3СООNa. Коэффициенты активности ионов считать равными единице.
333.Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
334. Определить активность ионов водорода и значение раН+ в 2,5·10-3 М растворе НСl, содержащем, кроме того, 2,5·10-3 моль/дм3 КСl.
335. Степень диссоциации слабой одноосновной кислоты в 0,2н растворе равна 0,03. Вычислить значения [Н+], [ОН-] и рОН для этого раствора.
Дата добавления: 2016-01-09; просмотров: 2168;
