Гальванический элемент
Гальванический элемент – это устройство, способное преобразовывать свободную энергию Гиббса окислительно-восстановительной реакции в электрическую.
Элемент состоит из двух электродов (например, цинк и медь), опущенных в растворы собственных солей (или другого электролита) и соединенных проводником.
Растворы солей также приведены в электрический контакт полупроницаемой мембраной или электролитическим ключом в виде стеклянной трубки, заполненной насыщенным раствором КСl.
При этом через проводник протекает электронный ток, а на электродах в растворе электролита протекают окислительно-восстановительные реакции. На внутреннем участке электрической цепи гальванического элемента (растворы солей и насыщенный раствор КСl) протекает ионный ток.
Например, для элемента Даниэля-Якоби:
– на аноде Zn0-2e=Zn2+ – окисление;
– на катоде Cu2+ +2e=Cu 0 – восстановление.
Уравнение токообразующей реакции:
Zn0+ Cu2+ =Zn2+ +Cu0.
Схема гальванического элемента: 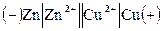 .
.
Электродвижущая сила (ЭДС) гальванического элемента (ε) выражается разностью установившихся электродных потенциалов катода и анода:
ε =ЕК-ЕА .
При стандартных условиях (при погружении металла в раствор собственного иона с одномоляльной концентрацией при температуре Т=25°С), электродный потенциал металла равен его стандартному электродному потенциалу (прил. 6).
В условиях, отличающихся от стандартных, электродный потенциал металла (Е) зависит от концентрации его ионов в растворе (при постоянной температуре), что выражается уравнением Нернста:
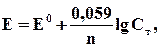
где Е0- стандартный электродный потенциал, В; n – число электронов, принимающих участие в процессе (заряд иона); Сm – моляльная концентрация (активность) гидратированных ионов металла в растворе, моль/кг Н2О.
Пример 1. Составьте схемы двух гальванических элементов, в одном из которых металл был бы катодом, а в другом – анодом. Напишите уравнения реакций, протекающих на электродах в гальванических элементах. Определите ЭДС элементов при температуре 298 К, если активность ионов обоих металлов в первом элементе равна 0,01 моль/кг Н2О, а в другом 1,0 моль/кг Н2О.
Решение.Металл – медь. Составим элемент, в котором медный электрод является катодом. Анодом можно выбрать любой металл, имеющий меньший электродный потенциал, например – магний.
Схема гальванического элемента: (-) Mg/ Mg2+//Cu2+/Cu (+).
Реакция на аноде: Mg(тв.)-2e=Mg2+(водн.)
Реакция на катоде: Cu2+(водн.) +2e=Cu(тв.)
Уравнение токообразующей реакции:
Mg(тв.) + Cu2+(водн.) =Mg2+(водн.) +Cu(тв.)
Значения потенциалов электродов рассчитаем по уравнению Нернста:
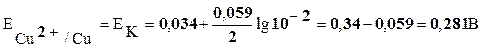 ,
,
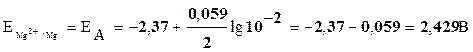 ,
,
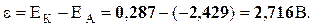
Составим элемент, в котором медный электрод является анодом. Катодом можно выбрать любой металл, имеющий больший электродный потенциал, например, ртуть:
(-)Cu / Cu 2+//Hg2+/ Hg (+).
Запишем уравнение реакций:
Cu(тв.)-2e=Cu2+(водн.) – на аноде;
Hg2+(водн.) +2e=Hg(ж.) – на катоде.
Суммарное уравнение:
Cu(тв.)+ Hg2+(водн.) =Cu2+(водн.) + Hg(ж.).
Так как активность ионов металла в растворах равна 1 моль/кг воды, то в данном элементе оба значения потенциалов – стандартные:
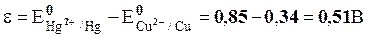 .
.
Ответ: ε=0,51 В.
Электролиз
Электролизом называется процесс раздельного окисления и восстановления на электродах, опущенных в раствор электролита, осуществляемый за счет протекания тока от внешнего источника ЭДС. При этом на аноде происходит окисление, а на катоде – восстановление и выделение металла. При электролизе расплавов электролитов на катоде всегда протекает восстановление катионов:
Меn++ ne= Ме0
На аноде – окисление соответствующих анионов:
Аnm—- me- = Аn0
Как правило, анодный процесс сопровождается вторичными химическими реакциями – рекомбинацией атомов в молекулы:
2Аn0=( Аn0)2
либо распадом нейтральной сложной частицы на два вещества, одно из которых является простым:
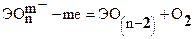
Например:
SО42- - 2 е → [SО40] → SО2 + О2
NO3- - е → [NO30] → NO + О2
Пример 1.Написать уравнения процессов, происходящих при электролизе расплава фторида алюминия AlF3 (материал катода – алюминий, материал анода – графит).
Решение:
В расплаве AlF3 диссоциирует согласно уравнению:
AlF3↔Al3++3F-
Под действием электрического поля катионы Al3+ движутся к катоду и принимают от него электроны:
Al3+ + 3е-→ Al0 – процесс восстановления.
Анионы F- движутся к аноду и отдают электроны:
F- - е-→ F 0 – процесс окисления,
2 F 0→ F2
| |
 Al3+ + 3е-→ Al0
Al3+ + 3е-→ Al0
2F- - 2е-→ F20
 2 Al3+ + 6 F- →2 Al0 + 3 F20
2 Al3+ + 6 F- →2 Al0 + 3 F20
или
|
 2 AlF3 2 Al0 + 3 F20
2 AlF3 2 Al0 + 3 F20
В растворах электролитов электролиз осложняется возможностью участия молекул растворителя (например, воды) в электродных процессах. Если система, в которой проводят электролиз, содержит разные окислители, то на катоде будет восстанавливаться наиболее активный из них, т.е., окисленная форма той электрохимической системы, которой отвечает наибольшее значение электродного потенциала.
В зависимости от состава электролита на катоде могут протекать (в том числе и параллельно) следующие реакции:
1) восстановление катионов металла:
Меn++ ne= Ме0
2) восстановление молекул воды:
2Н2О + 2 е →Н2 + 2 ОН-
Первая реакция исключительно протекает в растворах солей только тех металлов, которые в ряду напряжения находятся после водорода, то есть имеют больший, по сравнению с водородом электродный потенциал.
Вторая – только в растворах наиболее активных металлов, находящихся в начале ряда напряжений вплоть до алюминия. Их электродный потенциал значительно отрицательнее потенциала водородного электрода в нейтральной водной среде (-0,41 В). Для растворов солей металлов, имеющих электродный потенциал, близкий к -0,41 В, и составляющих середину ряда напряжений, характерно протекание обеих катодных реакций.
В растворах кислот на катоде протекает водородная реакция:
2Н+ + 2 е →Н2
Следует отметить, что в качестве катода можно использовать любой токопроводящий материал, кроме наиболее активных щелочных и щелочноземельных металлов. Большинство других металлов, а также графит, устойчиво в любых электролитах при катодном заряжении.
Аналогично, при наличии в системе, подвергающейся электролизу, нескольких восстановителей, на аноде будет окисляться наиболее активный из них, т.е. восстановленная форма той электрохимической системы, которая характеризуется наименьшим значением электродного потенциала. На аноде может протекать несколько окислительных процессов:
1) растворение материала анода (кроме платины и графита):
Ме0- ne= Меn+
2) окисление анионов соли или кислоты
Аnm—- me- = Аn0
2Аn0=( Аn0)2
3) окисление молекул воды:
2Н20 - 4 е- →О2 + 4 Н+
На нерастворимых анодах (платина, графит и некоторые металлы, образующие на своей поверхности защитную токопроводящую оксидную пленку, например, Pb в растворе Н2SО4 образует PbО2) конкурируют реакции 2 и 3. Для бескислородных кислот и их солей предпочтительнее реакция 2, например:
2Cl- - 2 е → Cl2
В растворах кислородных кислот и их солей, а также фторидов металлов протекает исключительно реакция окисления молекул воды.
В водных растворах щелочей на нерастворимых анодах протекает гидроксильная реакция:
4ОН- - 4е = 2Н2О + О2
Пример 2.Написать уравнения процессов, происходящих при электролизе раствора хлорида меди (анод – черновая медная пластина).
Решение.Если анод изготовлен из металла, способного окисляться в условиях электролиза, как в данном случае, ионы из раствора на аноде не окисляются.Медь окисляется на аноде (черновая медная пластина) с переходом ионов меди в раствор: Cu0-2e=Cu2+,а на катоде выделяется чистая медь из раствора: Cu2++ 2e= Cu0. Суммарного уравнения электролиза, как правило, в этом случае не пишут.
Пример 3.Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия (анод платиновый).
Решение.Стандартный электродный потенциал системы
Na+ + е-→ Na0 (-2,71 В)
значительно отрицательнее потенциала водородного электрода в нейтральной водной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода:
2Н20 + 2 е →Н2 + 2 ОН-
а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство)
На аноде будет происходить электрохимическое окисление воды, сопровождающееся выделением кислорода
2Н20 - 4 е- →О2 + 4 Н+
поскольку отвечающий этой системе стандартный электродный потенциал (1,23В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему
2SО42- → S2О82- + 2 е-
Ионы SО42-, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два и складывая с уравнением анодного процесса, получаем суммарное уравнение процесса:
6Н20 → 2Н2↑ + 4ОН- + О2 + 4 Н+
 |  |

 Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SО42- в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SО42- в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:


 6Н20 + 2 Na2SО4 → 2Н2↑ + 4 Na+ + 4ОН- + О2 + 4 Н+ + 2SО42-
6Н20 + 2 Na2SО4 → 2Н2↑ + 4 Na+ + 4ОН- + О2 + 4 Н+ + 2SО42-
 |  | ||||
 | |||||
 Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве)
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве)
Количественно электролиз описывается двумя законами Фарадея:
1. Масса выделяющегося на электроде вещества пропорциональна количеству прошедшего электричества:
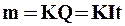 ,
,
где Q – количество электричества (заряд); I – сила тока; t – время протекания тока.
Если Q=1Кл, то К=m. Масса вещества, выделяющаяся при прохождении 1 Кл электричества, называется электрохимическим эквивалентом.
2. Для выделения на электроде одного эквивалента любого вещества необходимо затратить одно и то же количество электричества, равное постоянной Фарадея F=96483 Кл/моль.
Обобщенное выражение законов Фарадея:
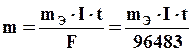 , (11.1)
, (11.1)
где m –масса вещества, г; mЭ– эквивалентная масса вещества, г/моль; I – сила тока, А; t – продолжительность электролиза, с.
Пример 4.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч, если сила тока равна 4 А?
Решение.Воспользуемся формулой (11.1). Эквивалентная масса mЭ меди в CuSO4 равна 63,54:2=31,77 г/моль; t=60*60=3600 c.
Подставив в формулу численные значения, получим
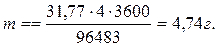
Ответ: m=4,74 г.
Пример 5.Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 38600 Кл электричества и на катоде выделилось 11,742 г металла.
Решение. Из формулы (11.1) имеем
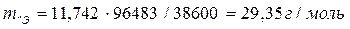 ,
,
где m=11,742 г, I×t=Q=38600 Кл.
Ответ: mЭ=29,35 г/моль.
Дата добавления: 2016-01-09; просмотров: 6012;
