Свойства растворов неэлектролитов
Разбавленные растворы неэлектролитов обладают рядом свойств, количественное выражение которых зависит от числа находящихся в растворе частиц растворенного вещества и от количества растворителя.
Зависимость этих свойств от концентрации выражается уравнениями, являющимися математическими выражениями законов Рауля и Вант-Гоффа:
1. Относительное понижение давления паров растворителя над раствором (D р) равно мольной доле растворенного неэлектролита (I закон Рауля):
D p= p0-p1= p0 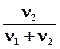 , (6.1)
, (6.1)
где р1 – парциальное давление насыщенного пара растворителя над раствором; р0 – давление насыщенного пара над чистым растворителем; n1 – количество растворителя; n2 – количество растворенного вещества.
2. При растворении неэлектролита расширяется температурный интервал существования жидкой фазы растворителя вследствие смещения его температуры кристаллизации (замерзания) в низкотемпературную область, а температуры кипения – в высокотемпературную (II закон Рауля):
D Тф.п. = К× Сm, (6.2)
где D Тф.п –изменение температуры фазового перехода (кристаллизации или кипения); К – коэффициент пропорциональности, зависящий от свойств растворителя; для кристаллизации – криоскопическая константа (Кк), для кипения – эбуллиоскопическая константа (Кэ). Для наиболее распространенного растворителя – воды эти константы равны: Кк = 1,86 К/моль, Кэ = 0,52 К/моль. Ст – моляльная концентрация растворенного вещества.
3. При постоянной температуре осмотическое давление раствора неэлектролита Р,Па, пропорционально его молярной концентрации (закон Вант-Гоффа):
Р=1000СМ RT,
где СМ – молярная концентрация; R – газовая постоянная (8,314 Дж/моль×К),
Т – температура, К.
Пример 1.При какой температуре замерзает водный раствор, полученный из 250 г воды и 54 г глюкозы С6Н12О6?
Решение.При пересчете на 1000 г воды, содержание глюкозы в растворе равно 216 г. Так как мольная масса глюкозы составляет 180 г/моль, то моляльность раствора равна Сm=216/180=1,20 моль/кг Н2О.
По формуле (6.2) находим D tкрист =К× Сm =1,86×1,20=2,23°С.
Так как чистая вода кристаллизуется при 0°С, то раствор будет кристаллизоваться при tкр р-ра= t кр.р-ля- D t крист=0-2,23=-2,230С.
Ответ:tкрист = - 2,23°С.
Пример 2. Давление пара воды при 25°С равно 23,76 мм рт. ст. Вычислить давление пара водного раствора, содержащего 18 г. мочевины CO(NH2)2 в 360 г воды.
Решение.Согласно условию задачи, р0 =23,76 мм рт. ст. Рассчитаем количество молей растворенного вещества (n2) и растворителя (n1):
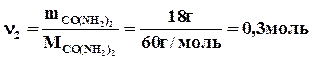 ,
,
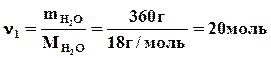 .
.
Отсюда, на основании формулы (6.1) получаем:

Ответ: р = 23,41 мм рт. ст.
Задачи к главе 6
Й уровень
246-250. Для приготовления антифриза на V, л, воды было взято m, г, вещества А.Чему равна температура замерзания приготовленного антифриза?
| Задачи | |||||
| V, л | 2,0 | 1,0 | 1,5 | 2,5 | 5,0 |
| А | C 2H 4(OH)2 | С3Н5(ОН)3 | С3Н5(ОН)3 | С3Н7ОН | С2Н5ОН |
| m, г |
251-255. Вычислите молярную массу вещества, если раствор, содержащий m, г, этого вещества на каждый литр воды, замерзает при температуре t°?
| Задачи | |||||
| m, г | 161,3 | 183,9 | 290,3 | 311,8 | |
| t,°С | -5 | -1 | -3 | -2 | -10 |
256-260. Вычислить осмотическое давление раствора, содержащего m, г, вещества А в х, г, воды при температуре 293 К. Плотность раствора считать равной единице:
| Задачи | |||||
| А | С12Н22О11 | С6Н12О6 | СО(NH2)2 | С3Н5 (OH)3 | С2Н4(OH)2 |
| m, г | |||||
| х, г |
Й уровень
261-265. Какойобъем вещества А плотностью r, кг/л, необходимо добавить на каждый литр воды , чтобы получить антифриз, замерзающий при температуре – 20°С?
| Задачи | |||||
| А | СН3ОН | С2Н4(ОН)2 | С3Н5(ОН)3 | С3Н7ОН | С2Н5ОН |
| r, кг/л | 0,8 | 1,1 | 0,8 | 1,3 | 0,8 |
266-270. Вычислитетемпературу кипения X %-го водного раствора вещества А:
| Задачи | ||||||
| А | (NH2)2CO | С4Н9ОН | С3Н7ОН | С2Н5ОН | С3Н5(ОН)3 | |
| X,% | 13,0 | 12,5 | 15,0 | 14,0 | 10,0 | |
271-275.Сколькограмм вещества А нужно растворить в V л воды, чтобы температура кипения полученного раствора равнялась t?
| Задачи | |||||
| А | (NН2)2СО | С12Н22О11 | С6Н12О6 | С6Н5NН2 | (СН2)6N4 |
| V, л | 1,2 | 0,8 | 1,5 | 1,8 | 0,7 |
| t°, С | 100,5 | 101,5 |
Й уровень
276-280. При температуре 315 К давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт.ст.). На сколько понизится давление пара при указанной температуре, если в m, г, воды растворить х, г, вещества А?
| Задачи | |||||
| А | С12Н22О11 | С6Н12О6 | С6Н5NН2 СО(NH2)2 | С3Н5 (OH)3 | С2Н4(OH)2 |
| m, г | |||||
| х, г | 15,5 5 |
281-285. Вкаком отношении должны находиться массы воды и спирта А, чтобы при их смешивании получить раствор, кристаллизующийся при температуре t?
| Задачи | |||||
| A | СН3ОН | С2Н5ОН | С4Н9ОН | С5Н11ОН | С3Н7ОН |
| t,°С | -15 | -20 | -25 | -10 | -30 |
Дата добавления: 2016-01-09; просмотров: 785;
