СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА
Растворомназывается гомогенная система,состоящая из двух или нескольких компонентов, относительное содержание которых может меняться в широких пределах.
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Наиболее часто употребляются в химии следующие способы выражения состава раствора:
1. Массовая доля wi – процентное отношение массы растворенного вещества к общей массе раствора.
2. Мольная доля Ni – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе.
3. Молярная концентрация СМ или молярность М – отношение количества растворенного вещества к объему раствора.
4. Моляльная концентрация Сm или моляльность μ – отношение количества растворенного вещества к массе растворителя.
5. Эквивалентная концентрация СН или нормальность н – отношение числа эквивалентов растворенного вещества к объему раствора.
6. Титр Т – это масса растворенного вещества в 1 см3 раствора, г/ см3.
Пример 1.Какую массу воды нужно прибавить к 200 мл 15%-го раствора Н2SO4 (r=1,11 г/мл), чтобы получить 10% раствор? Какова нормальность исходного раствора?
Решение.масса 200 мл 15%-ного раствора Н2SO4 равна 200×1,11=222 г. В этом растворе содержится 15% Н2SO4 т.е. 222×0,15=33,3 г.
1. По условию задачи эта масса составит 10% от общей массы разбавленного раствора. Тогда масса полученного раствора будет равна
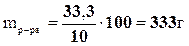 .
.
2. Следовательно, к исходному раствору необходимо добавить воды
mH2O = mр2-ра – m1 р-ра = 333-222=111г.
3. По определению, нормальность раствора равна количеству эквивалентов Н2SО4 в 1л раствора:
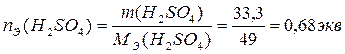 ,
,
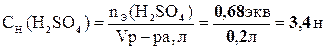 .
.
Таким образом, нормальность исходного раствора равна 3,4 экв/л.
Ответ: mН2О=111 г; СН=3,4 н.
пример 2. Рассчитать массу ВаСl2, содержащегося в 100 мл 0,3Н раствора. Какова массовая доля (%) и молярность этого раствора, если его плотность равна 1,05 г/мл?
Решение 1.В 100 мл 0,3н раствора ВаСl2 содержится 0,3×0,1=0,03 эквивалента ВаСl2. Эквивалентная масса ВаСl2 равна половине молярной массы, т.е. МЭ(ВаСl2) = 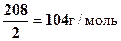 . Масса ВаСl2 в 100 мл 0,3 н раствора равна
. Масса ВаСl2 в 100 мл 0,3 н раствора равна
m(ВаСl2)=104×0,03=3,12 г.
2. Для нахождения массовой доли (%) найдем массу раствора:

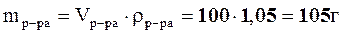 ,
, 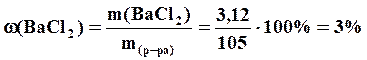

3. Молярность раствора равна количеству молей  в 1л раствора. Количество вещества
в 1л раствора. Количество вещества 
 определяется из выражения
определяется из выражения 
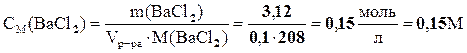
Ответ: m (ВаСl2) = 3,12 г; ω=3%, СМ=0,15 М.
Задачи к главе 5
Й уровень
206-210.Вкакой массе воды нужно растворить 100 г вещества А, чтобы получить Х% по массе раствор? Какова молярность этого раствора, если его плотность равна ρ г/мл?
| Задачи | |||||
| A | АlСl3 | ВаСl2 | Са(NО3)2 | Н3РO4 | К2СО3 |
| X, % | |||||
| ρ, г/мл ,,г/мл | 1,10 | 1,25 1 ,_ ~> | 1,08 | 1,10 | 1,05 |
211-215. Какуюмассу вещества А необходимо растворить в воде, чтобы получить 3 л 0,5 М раствора? Какова массовая доля (%) и моляльность этого раствора, если его плотность равна ρ?
| Задачи | |||||
| А | СrСl3 | НNО3 | ВаСl2 | СuSО4 | Zn(NO3)2 |
| ρ, г/мл | 1,07 | 1,02 | 1,09 | 1,08 | 1,08 |
216-220.Какой объем (мл) x-молярного раствора Н3PО4 можно приготовить из V, мл, y-молярного раствора? Какова нормальная концентрация приготовленного раствора ?
| Задачи | |||||
| X, моль/л | 1,50 | 0,50 | 0,75 | 3,50 | 2,25 |
| Y, моль/л | 2,25 | 1,75 | 3,00 | 5,25 | 4,50 |
| V, мл |
Й уровень
221-225. Вычислите нормальность и титр раствора Н2С2О4·2Н2О, полученного растворением Х, г ее в Y, см3, воды. Плотность полученного раствора принять равной 1 г/ см3:
| Задачи | |||||
| Х, г | 1,7334 | 0,8667 | 1,7334 | 0,8667 | 1,7334 |
| Y, см3 |
226-230. Смешали m1, г, X %-го по массе раствора Н2SО4 и m2, г, Y%-го по массе раствора Н2SО4. Какова массовая доля (%) Н2SО4 в смешанном растворе и его нормальная концентрация , если плотность смешанного раствора равна ρ?
| Задачи | |||||
| m1, г | |||||
| Х, % | |||||
| m2, г | |||||
| Y, % 1 , /0 | |||||
| ρ, г/мл | 1,08 | 1,18 | 1,05 | 1,13 | 1,07 |
231-235. К V, мл, 8,28%-го раствора NaОН плотностью 1,09 г/мл прибавили m, г X %-го раствора NаОН. Вычислите массовую долю (%) NаОН в полученном растворе:
| Задачи | |||||
| V, мл | |||||
| m,г ,г | |||||
| Х,% |
Й уровень
236-240. При охлаждении 2,0 кг Х%-го по массе раствора соли А из него выкристаллизовалось m, г, соли. Вычислите массовую долю (%) соли в охлажденном растворе и его нормальную концентрацию, если плотность охлажденного раствора равна r:
| Задачи | |||||
| А | СаBr2 | СrСl3 | К2СО3 | Nа3РО4 | SnСl4 |
| Х, % | |||||
| m, г | 95,0 | 44,4 | 136,4 | 63,2 | 174,0 |
| r, г/мл | 1,15 | 1,10 | 1,10 | 1,05 | 1,06 |
241-245. В каком объеме воды нужно растворить m, г, кристаллогидрата А, чтобы получить Х%-ый по массе раствор безводной соли?
| Задачи | |||||
| А | СuSO4·5H2O | ВаСl2·2H2O | ZnSO4·7H2O | FeSO4·7H2O 4 | СаСl2·6H2O |
| m, г Х,% | |||||
| Х, % | 5,0 | 4,4 | 6,4 | 3,2 | 1,7 |
Дата добавления: 2016-01-09; просмотров: 878;
