Химическое сродство
Чтобы понимать химические процессы и управлять ими, необходимо знать ответ на вопрос: каковы движущие силы и критерии самопроизвольных химических процессов. Одной из движущих сил химической реакции является уменьшение энтальпии системы, т. е. экзотермический тепловой эффект реакции. Как показывает опыт, большинство экзотермических (DН<0) реакций протекают самопроизвольно. Но кроме энтальпийного фактора имеется другая движущая сила самопроизвольного процесса. Это стремление системы к переходу от более упорядоченного состояния к менее упорядоченному. Мерой неупорядоченности состояния системы служит термодинамическая функция, получившая название энтропии. Состояние системы можно характеризовать микросостояниями составляющих ее частиц. Число микросостояний системы называется термодинамической вероятностью системы W. Величина, равная RlnW= S, называется энтропией системы, отнесенной к одному молю вещества. Как и молярная постоянная R, энтропия имеет единицу измерения Дж/(моль×К). Энтропия вещества в стандартном состоянии называется стандартной энтропией 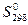 .
.
Т.к. энтропия является функцией состояния системы, то для вычислений изменения стандартной энтропии химической реакции DSх.р применяют следствие из закона Гесса (с учетом стехиометрических коэффициентов):
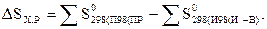 .
.
Таким образом, в химических процессах проявляются две тенденции: а) стремление к образованию прочных связей между частицами, к возникновению более сложных веществ, сопровождающееся понижением энергии системы (энтальпийный фактор); б) стремление к разъединению частиц, к беспорядку, характеризуемое возрастанием энтропии (энтропийный фактор).
Для изохорно-изотермических процессов возможность самопроизвольного протекания определяется через объединяющий эти два фактора изохорно-изотермический потенциал или энергию Гельмгольца:
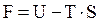 ,
,
изменение этой величины ΔF равно
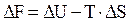 .
.
В системах, находящихся при постоянной температуре, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением величины F при постоянном объеме.
Для изобарно-изотермических процессов энтальпийный и энтропийный факторы объединены функцией, называемой свободной энергией Гиббса или химическим сродством G. Ее рассчитывают как равнодействующую вышеупомянутых факторов реакции:
 |
Свободная энергия Гиббса связана с энтальпией и энтропией следующим соотношением:
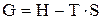 .
.
Изменение свободной энергии Гиббса ΔG является движущей силой реакции (разностью химических потенциалов) подобно ЭДС в электрических процессах (ΔЕ) или перепаду давлений в гидравлических процессах (ΔР):
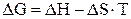
и может быть рассчитано по следствию из закона Гесса:
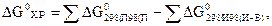
В системах, находящихся при постоянной температуре, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением величины G при постоянном давлении.
Найдя величину ΔG0х.р, можно вычислить константу химического равновесия реакции Kp, являющуюся количественной характеристикой положения равновесия (предел протекания реакции):
ΔG = -RTlnKp.
Для окислительно-восстановительных реакций (в том числе и лежащих в основе работы гальванических элементов) через свободную энергию Гиббса можно определить разность окислительно-восстановительных потенциалов или ЭДС элемента (ΔЕ):
ΔG = -nFΔЕ,
где n – число принятых или отданных электронов в окислительно-восстановительном процессе; F – число Фарадея, F = 96483 Кл/моль; ΔЕ – разность окислительно-восстановительных потенциалов или ЭДС элемента, В.
Пример 2.Может ли реакция I2(K) +H2S (Г)=2HI(Г)+S(K) при стандартных условиях протекать самопроизвольно в прямом направлении. Как скажется повышение температуры на направлении протекания этой реакции?
Решение. Выпишем значения 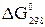 для веществ, участвующих в реакции (прил. 3):
для веществ, участвующих в реакции (прил. 3):
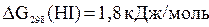 ;
;
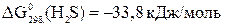 ,
,
тогда 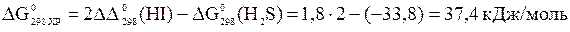 .
.
Положительный знак 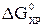 означает, что эта реакция при Т=298 К и р=101,325 кПа самопроизвольно протекать не может. В этой реакции число молей веществ в газообразном состоянии возрастает,
означает, что эта реакция при Т=298 К и р=101,325 кПа самопроизвольно протекать не может. В этой реакции число молей веществ в газообразном состоянии возрастает, 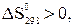 т.е. в уравнении
т.е. в уравнении 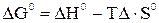 член ТDS-отрицателен. Следовательно, с повышением температуры значение
член ТDS-отрицателен. Следовательно, с повышением температуры значение 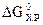 будет уменьшаться. Это означает, что повышение температуры будет благоприятствовать протеканию реакции в прямом направлении.
будет уменьшаться. Это означает, что повышение температуры будет благоприятствовать протеканию реакции в прямом направлении.
Задачи к главе 3
Й уровень
91-95. Рассчитайтестандартный тепловой эффект реакции, предварительно подобрав коэффициенты в уравнении, и установите, является ли реакция экзо- или эндотермической. Стандартные энтальпии образования реагентов А, В и продуктов С и D взять из прил.3:
Задачи Реакции
A B C D
 91 CuCl2(т) + H2O(г) CuO(т) + HCl(г)
91 CuCl2(т) + H2O(г) CuO(т) + HCl(г)
 92 Al2(SO4)3(т) Al2O3(т) + SO3(г)
92 Al2(SO4)3(т) Al2O3(т) + SO3(г)
 93 CS2(ж) + O2(г) CO2(г) + SO2(г)
93 CS2(ж) + O2(г) CO2(г) + SO2(г)
 94 HF(г) +N2(г) NF3(г) + H2(г)
94 HF(г) +N2(г) NF3(г) + H2(г)
 95Na2SO3(т)Na2SO4(т) + Na2S(т)
95Na2SO3(т)Na2SO4(т) + Na2S(т)
96-100По термохимическому уравнению взаимодействия реагентов А и В, рассчитайте стандартную энтальпию образования продукта D. Известны (прил. 3) стандартный тепловой эффект химической реакции 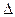 Н°х.р. и стандартные энтальпии образования реагентов
Н°х.р. и стандартные энтальпии образования реагентов 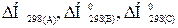 :
:
| Задачи | Реакции | |||||
| А | В | С | D | 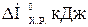
| ||
 96 96
| Na2O(т) | + SO3(т) | + H2O(ж) | NaHSO4(т) | -650 | |
 97 97
| Na2O(т) | + SO2(г) | + S(т) | Na2 S2O3(т) | -402 | |
 98 98
| CuO(т) | + NO2(г) | + O2(г) | Cu(NO3)2(т) | -440 | |
 99 99
| H2O(г) | + CO2(г) | + CuO(т) | Cu2(OH)2CO3(т) | -101 | |
 100 100
| MgO(т) | + NO2(г) | + O2(г) | Mg(NO3)2(т) | -510 |
101-105. По термохимическому уравнению рассчитайте стандартную энтальпию образования реагента А, если известны стандартные энтальпии образования веществ В, С и D (прил. 3).
ЗадачиРеакции
A B C D 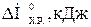
 101KClO4(т) KClO3(т) + KCl(т) + O2(г) +60
101KClO4(т) KClO3(т) + KCl(т) + O2(г) +60
 102Mg(NO3)2(т) MgO(т) + NO2(г) + O2(г) +510
102Mg(NO3)2(т) MgO(т) + NO2(г) + O2(г) +510
 103Na2CO3×10H2O(т) NaOH(т) + CO2(г) + H2O(г) +662
103Na2CO3×10H2O(т) NaOH(т) + CO2(г) + H2O(г) +662
 104KH2PO4(т) KOH(т) +P4O10(т) + H2O(ж) +1020
104KH2PO4(т) KOH(т) +P4O10(т) + H2O(ж) +1020
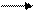 105NaHCO3(т) Na2O(т) +CO2(г) + H2O(ж) +338
105NaHCO3(т) Na2O(т) +CO2(г) + H2O(ж) +338
106-110. Рассчитайтестандартное изменение энтропии реакции, предварительно подобрав коэффициенты в уравнении, и установите, будет ли она протекать самопроизвольно в изолированной системе при стандартных условиях. Необходимые данные взять из прил. 3:
Задачи Реакции
106NiO(т)+Al(т)=Ni(т)+Al2O3(т)
107V(т) +CaO(т) =V2O5(т) +Ca(т)
108SO2(г) +H2S(г) =S(т) +H2O(ж)
109N2H4(г) +O2(г) =N2(г) +H2O(г)
110PbS(т) +O2(г) =PbO(т) +SO2(г)
111-115. Рассчитайте при температуре 25оС стандартное изменение свободной энергии Гиббса образования оксида из соответствующих простых веществ, если известны стандартные энтальпии образования ( 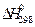 ,кДж/моль) и стандартные энтропии образования(Δ
,кДж/моль) и стандартные энтропии образования(Δ 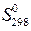 ,Дж/(моль·К)) данного оксида. Может ли данная реакция протекать самопроизвольно?
,Дж/(моль·К)) данного оксида. Может ли данная реакция протекать самопроизвольно?
| Задачи | |||||
| Оксид | Fе2О3 | РbО2 | ZnО | Аl2О3 | ВаО |
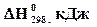
| -824 | -277 | -581 | -1675 | -538 |
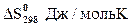 ,ДЖ/мольК ,ДЖ/мольК
|
116-120. Поприведенным стандартным значениям изменения энтальпии и энтропии для химической реакции рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции. В каком направлении, прямом или обратном, данная реакция будет протекать самопроизвольно при более высоких температурах?
| Задачи | Реакция | 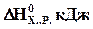
| 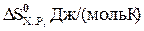
|
| СО2(г)+С(г)=2СО(г) | + 173 | +176 | |
| N2(г)+3Н2(г)=2NH3(г) | -92 | -201 | |
| 2NO(г)+О2(г)=2NO2(г) | -116 | -147 | |
| SО2(г)+Сl2(г)=SС12О2(г) | -67 | -159 | |
| Сl2(г)+5F2(г)=2СlF5(г) | -478 | -616 |
Й уровень
121-125. Вычислите количество теплоты, выделившееся при сгорании углеродсодержащего топлива А массой m, в котором также содержится негорючий компонент с массовой долей Сm. Считать, что горючим компонентом в топливе является углерод С(т):
| Задачи | |||||
| А | Антрацит | Бурый уголь | Каменный уголь | Горючий сланец | Кокс |
| m, кг | |||||
| Cm, % ^т. /о |
126-130. Вычислите, какое количество теплоты выделится при восстановлении оксида А металлом Б, если было получено m, г, восстановленного металла:
| Задачи | |||||
| A | Fе2О3 | ТiO2 | Сr2О3 | СdО | РbО |
| Б | Аl | Са | Mg | Аl | Zn |
| m, г |
131-135. Оцените при стандартных условиях возможность самопроизвольного протекания реакции восстановления металла из его оксида с помощью восстановителей А и В:
| Задачи | |||||
| Оксид | Sb2O5 | Fе3О4 | Вi2О3 | WO3 | ZrO2 |
| А, В | С, Н2 | Са, Н2 | С, Н2 | С, Н2 | Са, Н2 |
136-140. Определите знаки при D Н° и D S° для реакции, протекающей при стандартных условиях в прямом направлении. Как будет изменяться DG° (возрастать или убывать), если температура будет изменяться так, как указано в условии?
| Задачи | Реакция | Температура | |
| 2АВ(т)+В2(г)=2АВ2(т) | возрастает | ||
| АВ5(т) =АВ3(т) +В2(г) | уменьшается | ||
| 2А(ж)+ВС(г)=А2ВС(ж) | уменьшается | ||
| АВ(т)+В(ж)=АВ2(т) | возрастает | ||
| А2В3(г)=2А2В(ж) + В2(г) | возрастает | ||
141-145. Для данной реакции оцените возможность самопроизвольного ее протекания при температуре 298 К.
| Задачи | Реакция |
| H2(г) + Cl2(г) + O2(г) = HСlO4(ж) | |
| Ca(т) + P(т) + O2(г) = Ca3(PO4)2(т) | |
| H2(г) + N2(г) + O2(г) = HNO3(ж) | |
| N2(г) +2 H2(г) = N2H4(г) | |
| Ca(т) + C(т) + O2(г) = CaCO3(т) |
146-150. Рассчитайте температуру, при которой возможно протекание данной реакции в прямом направлении:
| Задачи | Реакция | |
| СН4(г)= С(т) + 2Н2(г) | ||
| Са3(РO4)2(т) = СаО(т) + Р2O5(т) | ||
| Mg(NO3)2(т) = MgO(т) + N2O5(г) | ||
| 2Н2О(г) = 2 H2(г) + O2(г) | ||
| Nа2SО3(т) = Nа2О(т) + SО2(г) | ||
Й уровень
151.Раствор ацетата натрия, содержащий фенолфталеин, при Т =298 К обесцвечивается, а при нагревании становится розовым. На основании этого определите знаки при 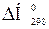 и
и 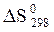 наблюдаемого процесса, напишите его уравнение.
наблюдаемого процесса, напишите его уравнение.
152. Почему при растворении в воде кристаллического хлорида калия энтропия увеличивается, а при растворении газообразного диоксида углерода – уменьшается?
153. Каков знак изменения энергии Гиббса процесса таяния льда при 273 К?
154. Стандартные энтальпии образования (кДж/моль) гидридов азота (III) и фосфора (III) равны соответственно -46,2 и 5,4. Сделайте вывод об относительной устойчивости этих веществ.
155. Предварительно подобрав коэффициенты в уравнении, рассчитайте энтальпию образования реагента Fe3O4 при стандартных условиях, если известны стандартные энтальпии остальных реагентов и продуктов реакции, а также стандартный тепловой эффект реакции ∆Н0х.р= 37 кДж:
СО(г) + Fe3O4(т) → FeO(т) + СO2(г)
156-160. Постандартному изменению энтропии в реакциях (I) и (II) рассчитайте стандартную энтропию образования указанного вещества из простых веществ. Напишите уравнение реакции образования этого вещества из простых веществ:
| Задачи | Реакции | ΔS°, Дж/(мольК) | Вещество | |||
| (I) 2С(т)+O2(г)=2СО(г) (II) СO(г)+F2(г)= СОF2(г) | + 179 -143 | СОF2 | ||||
| (I) 2Сr(т)+3F2(г)=2СrF3(т) (II) 2СrF2(т)=2СrF2(т)+F2(г) | -469 -40; | СгF2 | ||||
| (I) Zr(т)+ZrСl4(г)=2ZrСl2(г) (II) Zr(т)+2Сl2(г)=ZrСl4(г) | +208 -116; | ZrСl2 | ||||
| (I) 2Аs(Т)+3F2(г)=2АsF3(г) (II) АsF5(г)=АsF3(г)+F2(г) | -103 + 139; | АsF5 | ||||
| (I) 2СlF5(г)=Сl2F6(г)+2F2(г) (II) Сl2(г)+5F2(г)=2СlF5(г) | +346 -616 | Сl2F6 | ||||
Дата добавления: 2016-01-09; просмотров: 1822;
