Геометрические и энергетические характеристики атомов
Атомный радиус.Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
Энергия ионизации Еi –это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома, количественно выражается в кДж/моль или эВ. Чем меньше энергия ионизации, тем легче атом отдает электрон при образовании химической связи, т.е. элемент является более сильным восстановителем. Поэтому восстановительная способность нейтральных атомов с ростом заряда ядра в периоде уменьшается, в главных подгруппах растет.
Энергия сродства к электрону Еср –энергия, выделяющаяся при присоединении электрона к нейтральному атому, количественно выражается в кДж/моль или эВ. Она определяет окислительные свойства несвязанных атомов. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2, s2р6. У остальных элементов в таблице Д.И. Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Электроотрицательностью элемента (ЭО)называют меру относительной способности атомов оттягивать на себя электроны при образовании химической связи. Она пропорциональна как энергии ионизации, так и энергии сродства к электрону. Имеется несколько шкал электроотрицательности. Согласно Р. Малликену, абсолютная электроотрицательность равна полусумме энергии ионизации и сродства к электрону:
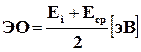 ,
,
Л. Полинг ввел относительную шкалу электроотрицательности (ОЭОR):
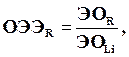
С ростом заряда в периодах электроотрицательность в общем растет, а в подгруппах падает.
Химическая связь.
Под химической связью понимают результат взаимодействия двух и более атомов, приводящий к образованию устойчивой многоатомной системы.
Важнейшими видами химической связи являются: ковалентная, ионная водородная, металлическая, межмолекулярная.
При образовании ковалентной связи между атомами их электроны обобщаются и локализуются между ними.
Число общих электронных пар,соединяющих два атома,определяет кратность химической связи.
Длина химической связи характеризует межъядерное расстояние в молекуле. Чем больше кратность связи, тем меньше ее длина при прочих равных условиях.
Прочность химической связи (энергия разрыва или диссоциации) – это количество энергии, необходимой для ее разрыва. Чем короче связь, тем больше энергия ее разрыва в том случае, если сравниваются однотипные связи.
Химическая связь, образованная при перекрывании атомных орбиталей (АО), расположенных вдоль прямой линии, проведенной через ядра взаимодействующих атомов, называется σ (сигма)-связью. Между двумя атомами в молекуле возможна только одна σ–связь. Углы между σ–связями называются валентными углами.
При перекрывании АО, расположенных перпендикулярно или под иными углами к σ-связи и параллельно друг к другу происходит образование π (пи) и δ (дельта)-связей. Перекрывание АО при этом меньше, чем при σ, поэтому π- и δ-связи, как правило, слабееσ-связи.
Под направленностью химической связи понимают валентные углы, которые образуются между химическими связями в молекулах, состоящих из трех и более атомов. Для предсказания геометрического строения молекул типа АВn, где n>1, и значений валентных углов применяют идею гибридизации атомных орбиталей.
Подполярностью химической связипонимают асимметрию в распределении электронной плотности между атомами, образующими химическую связь.
В двухатомных молекулах простых веществ (таких, как Н2, О2, Cl2 и др.) электронная плотность около обоих атомов одинакова, а сама связь является неполярной.
Если связь образована атомами разных элементов, то один из них, как правило, притягивает общую электронную пару сильнее. Тогда симметрия распределения зарядов нарушается и полюс отрицательных зарядов не совпадает с положительным полюсом. Вследствие этого связь становится полярной.
С увеличением разности электроотрицательностей (Δ ЭО), участвующих в образовании связи атомов, возрастает эффективный заряд на атомах, т.е. возрастает степень ионности связи. Для 100% степени ионности связи ΔЭО, рассчитанная по относительной шкале электроотрицательностей элементов, должна быть равной 3,5. При ΔЭО>1,9, когда эффективный заряд атомов становится больше ±0,5, вполне допустимо рассматривать атомы как ионы с целочисленными зарядами, а связь между ними считать ионной.
Химическая связь считается локализованной (ограниченной определенным местом), если осуществляющие ее электроны принадлежат только двум связываемым атомам. Связь является нелокализованной,если электрон или электроны осуществляют связь более, чем между двумя атомами. Типичным примером нелокализованной связи является металлическая химическая связь,т.к. электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему объему металла, в целом электронейтральному.
Водородная связь характерна для атома водорода, связанного непосредственно с наиболее электроотрицательными элементами F, N, O и другими. Она может быть межмолекулярной и внутримолекулярной. В первом случае связь возникает между водородом и электроотрицательным элементом другой молекулы, а внутримолекулярная – между атомами этих элементов в одной молекуле.
Пример 3. Определите тип химической связи в молекулах Cl2, НCl, КCl, ЅО2, Н2Ѕ.
Решение.Молекула Cl2 – двухатомная молекула простого вещества. Такие молекулы являются неполярными и химические связи в них также неполярные.
Для определения типа внутримолекулярной химической связи в других веществах находим разности относительных электроотрицательностей входящих в них элементов, используя прил. 2, и сравниваем полученный результат с нормируемым значением для ионной связи ΔЭО>1,9.
НCl: Δ ЭО = 3,0-2,1=0,9 (результат меньше 1,9, следовательно для данного соединения характерна ковалентная полярная связь);
КCl: Δ ЭО = 3,0-0,8=2,2 (>1,9, связь ионная);
ЅО2: Δ ЭО =3,5-2,5 =1,0 (<1,9, ковалентная полярная связь)
Н2Ѕ: Δ ЭО =2,5-2,1=0,4 (<1,9, ковалентная полярная связь)
Задачи к главе 2
Й уровень
41-45. Составьте электронную формулу атома элемента с порядковым номером Z. К какому электронному семейству принадлежит этот элемент? Составьте уравнение β--распада ядра изотопа этого элемента с массовым числом А. Учесть, что в задаче 42 изотоп распадается с выделением двух β-частиц:
| Задачи | |||||
| Z | |||||
| А |
46-50. Укажите в периодической системе элемент, валентные электроны которого имеют конфигурацию Z. Напишите полную электронную формулу этого элемента. Составьте уравнение β+-распада ядра изотопа этого элемента с массовым числом А:
| Задачи | |||||
| Z | 3s23p1 | 3d54s2 | 5s2 | 3d14s2 | 4s24p2 |
| А |
51-55. Какие значения квантовых чисел n, l, m1, ms, имеют валентные электроны элемента А? Напишите электронную формулу элемента:
| Задачи | |||||
| A | 37Rb | 4Be | 31Ga | 20Ca | 3Li |
56-60. Составьте уравнение реакции ядерного обмена согласно схеме  для изотопа элемента, содержащего Z протонов с массовым числом А.
для изотопа элемента, содержащего Z протонов с массовым числом А.
| Задачи | |||||
| Z | |||||
| А |
Й уровень
61-65. Определите тип химической связи в молекуле вещества А, изобразите ее структурную формулу:
| Задачи | |||||
| A | Аl2О3 | СS2 | СBr4 | РН3 | СаF2 |
66-70. Руководствуясь периодической системой, укажите символ химического элемента, иону которого с зарядом А соответствует электронная конфигурация валентных электронов Б. Для найденного элемента приведите его электронную формулу:
| Задачи | |||||
| А | 2+ | 1- | 3+ | 3- | 2+ |
| Б | 3d5 | 2s22p6 | 3d5 | 4s24p6 | 3d2 |
71. По значениям энергии ионизации атомов (эВ) определите, какой из приведенных элементов имеет наиболее ярко выраженные восстановительные свойства: К (4,34), Са (6,11), Rb (4,18), Sr (5,69).
72. Энергия ионизации атомов I, Cl, Br, F имеет значения (эВ): 11,84; 12,97; 10,45; 17,42. Атому какого элемента соответствует значение энергии ионизации 10,45 эВ?
73. По значению энергии сродства к электрону (эВ) выберите элемент, у которого наиболее ярко выражены окислительные свойства: Br (3,37), О (1,47), С (1,27), Cl (3,61).
74. Энергия ионизации атомов Mg, Al, Na, Cl имеет значения (эВ): 5,99; 5,14; 12,97; 7,65. Атому какого элемента соответствует значение энергии ионизации 12,97 эВ?
75. По значениям энергии ионизации атомов (эВ) определите, какой из приведенных элементов имеет наиболее ярко выраженные восстановительные свойства: К (4,34), Al (5,99), Ni(7,64), Sс (6,56).
3-й уровень
76-80. Определите число связей и их характер в соединении А:
| Задачи | |||||
| А | SiH4 | SiO2 | K2SiF6 | С2Н6 | СCl4 |
81.Как и почему изменяется длина связи в ряду: CF4, CCl4, CBr4?
82. Сколько σ- и π-связей имеется в молекулах С2Н2 и РН3?
83. Составьте электронную формулу хрома, содержащегося в соединении Cr2(SO4)3.
84.Определите тип гибридизации орбиталей атома металла в молекуле хлорида кальция и изобразите геометрическую форму молекулы.
85. Определите тип гибридизации орбиталей атома азота в ионе аммония и изобразите геометрическую форму частицы.
86. При бомбардировке некоторого изотопа нейтронами происходит поглощение одного нейтрона и, впоследствии, испускание двух высокоэнергетических электронов. При этом образуется изотоп 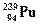 . Какие материнские ядра участвуют в обменной реакции? Составить полное и краткое уравнения этой реакции.
. Какие материнские ядра участвуют в обменной реакции? Составить полное и краткое уравнения этой реакции.
87. Какую ускоренную частицу поглощает материнское ядро 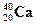 , если при этом образуется дочернее ядро
, если при этом образуется дочернее ядро 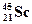 и два высокоэнергетических протона? Составить полное и краткое уравнения этой реакции.
и два высокоэнергетических протона? Составить полное и краткое уравнения этой реакции.
88. Сколько и каких высокоэнергетических частиц выбрасывает ядро 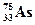 , поглотившее четыре нейтрона, образуя стабильный изотоп
, поглотившее четыре нейтрона, образуя стабильный изотоп 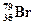 ? Составить полное и краткое уравнения этой реакции.
? Составить полное и краткое уравнения этой реакции.
89. Изотоп 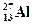 , подвергаясь α-облучению, участвует в обменной реакции:
, подвергаясь α-облучению, участвует в обменной реакции: 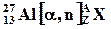 . Образующиеся при этом ядра
. Образующиеся при этом ядра 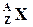 являются радиоактивными (искусственная радиация) и подвергаются β+-распаду, выбрасывая один высокоэнергетический позитрон. Изотоп какого элемента образуется из алюминия в конечном итоге? Составить уравнения всех описанных реакций.
являются радиоактивными (искусственная радиация) и подвергаются β+-распаду, выбрасывая один высокоэнергетический позитрон. Изотоп какого элемента образуется из алюминия в конечном итоге? Составить уравнения всех описанных реакций.
90. Изотоп ртути 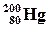 участвует в двух обменных ядерных реакциях:
участвует в двух обменных ядерных реакциях:
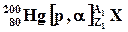 и
и 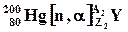 . В какой их этих реакций образуется β-радиоактивный изотоп? Составить уравнения обменных реакций и схему β--распада образующегося в одной из них изотопа, обладающего искусственной радиоактивностью.
. В какой их этих реакций образуется β-радиоактивный изотоп? Составить уравнения обменных реакций и схему β--распада образующегося в одной из них изотопа, обладающего искусственной радиоактивностью.
Дата добавления: 2016-01-09; просмотров: 1624;
