Следствия из закона Авогадро.
1. 1 моль любого газа при данных условиях занимает один и тот же объем – молярный объем.
2. При нормальных условиях 1 моль различных газов занимает объем 22,4 л.
Относительная плотность одного газа по другому.
Молярную массу газа можно определить по его плотности ρ[г/л] :
Мгаза= 22,4· ρ.
Плотности газов при одинаковых условиях относятся как их молярные массы:
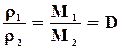 ,
,
где D – относительная плотность одного газа по другому.
Задачи к главе 1
Й уровень
1-5. При взаимодействии m, г, n-валентного металла с серной кислотой выделилось V, мл, (н.у.) водорода. Рассчитайте эквивалентную и мольную массы металла, массу прореагировавшей кислоты и массу образовавшейся соли. Какой металл был взят для растворения? Напишите реакцию взаимодействия этого металла с серной кислотой:
| Задачи | |||||
| m, г | 0,08 | 0,10 | 0,12 | 0,16 | 0,18 |
| n | |||||
| V,мл (н.у.) | 27,4 | 124,5 | 89,6 | 147,5 | 72,2 |
6-10. Оксид n-валентного элемента содержит Х% этого элемента. Вычислите эквивалентные и мольные массы элемента и оксида. Какой элемент образует данный оксид? Напишите уравнение реакции образования этого оксида при взаимодействии элемента с кислородом:
| Задачи | |||||
| n | |||||
| X,% | 87,5 | 69,9 | 69,4 | 43,6 | 46,8 |
11-15.При превращении m1, г, хлорида металла в сульфат было затрачено m2, г, серной кислоты. Определите эквивалентные массы металла, его хлорида и сульфата. Какой это металл, если его валентность равна n?
| Задачи | |||||
| m1, г | 1,71 | 1,75 | 2,03 | 1,305 | 2,10 |
| m2 , г | 1,66 | 1,47 | 1,58 | 0,99 | 1,395 |
| n |
Й уровень
16-20. В нижеприведенной реакции определите факторы эквивалентности и эквивалентные массы исходных веществ. Для окислительно-восстановительных реакций найдите массу окислителя при условии, что в реакцию вступило 100 г восстановителя. Для реакции ионного обмена рассчитайте массу образовавшейся соли, если в реакцию вступило 100 г кислоты. При расчетах используйте закон эквивалентов:
16.КMnО4+КОН+К2SО3→К2МnО4+К2SО4+Н2О
17.KJО3+Н2SО4+Nа2SО3 →J2+К2SО4+Nа2SО4+Н2О
18.Al(OH)3 + H2SO4 →AlOHSO4 + H2O
19.СrС13+КОН+Вr2 → К2СrO4+КВr+Н2О+КСl
20.PbO2 + Mn(NO3)2 +HNO3 →HMnO4+Pb(NO3)2 +H2O
21-25. Взято m г некоторого вещества А. Вычислите его эквивалентную массу, если известно, что данная масса содержит В, г, ионов С. Рассчитайте эквивалентные массы катиона металла (для основания) и аниона кислотного остатка (для кислоты).
| Задачи | |||||
| m, г | 15,6 | ||||
| А | основание | кислота | основание | кислота | основание |
| В,г | 0,7 | 0,1 | 10,2 | 0,1 | 1,7 |
| С | ОН- | Н+ | ОН- | Н+ | ОН- |
26-30. Рассчитайте эквивалентные объемы исходных веществ - газов в следующих реакциях:
26.SО2+НВrО3+Н2О →Н2SО4+Вr2
27.SО2+КМnО4+КОН →К2SО4+МnО2+Н2О
28.К2Сr2О7+Н2S+ Н2SО4→Сr2(SО4)3+S+ К2SО4+Н2О
29.Н2 SО3 + С12+Н2О →Н2 SO 4 +НС1
30. NH3 + СuО → N2 + Сu + Н2О
Й уровень
31-35. Какой объем (н.у.) вещества А образуется при взаимодействии N молекул вещества Б с кислородом:
| Задачи | |||||
| А | Оксид азота (ll) | Оксид серы (lV) | Оксид серы (lV) | Оксид азота (ll) | Оксид углерода (lV) |
| N | О,5·1021 | 2,5·1022 | 2,5·1023 | О,5·1021 | 4,5·1023 |
| Б | азот | сера | сероводород | аммиак | углерод |
36.При некоторой температуре плотность паров серы по воздуху равна 6,62. Из скольких атомов состоят молекулы серы?
37. При некоторой температуре плотность паров фосфора по воздуху равна 4,28. Из скольких атомов состоят молекулы фосфора?
38.Плотность галогеноводорода по воздуху равна 4,41. Какова плотность этого газа по водороду?
З9. Плотность галогеноводорода по воздуху равна 2,79. Какова формула этого галогеноводорода?
40.Найдите плотность по кислороду газовой смеси, состоящей из азота и углекислого газа, объемные доли которых равны соответственно 60 и 40%.
Дата добавления: 2016-01-09; просмотров: 1151;
