Фактор эквивалентности химического элемента Х в его соединениях равен
Основные понятия и законы химии
Относительная атомная масса (Аr)химического элемента показывает, во сколько раз средняя масса атома естественного изотопного состава элемента больше 1/12 массы изотопа углерода-12 (12С):
Аr = mатома: (1/12 m (12С)).
Относительная молекулярная масса (Мr)простого или сложного вещества показывает, во сколько раз средняя масса молекулы естественного изотопного состава элемента больше 1/12 массы изотопа углерода-12 (12С):
Мr = mмолекулы: (1/12 m (12С)).
Атомная единица массы (а.е.м.) = 1,66·10-27кг; Аr и Мr –безразмерные величины.
Количество вещества ν – физическая величина, равная количеству молей структурных элементов, составляющих систему. Определяется ν отношением числа структурных единиц N, содержащихся в системе, к постоянной Авогадро NА:
ν = N : NА.
Моль– это количество вещества системы, содержащей столько же структурных единиц, сколько содержится атомов в углероде 12С,взятогомассой 0,012 кг. Принято считать, что число структурных единиц в одном моле численно равно постоянной Авогадро NА = 6,02·1023 моль-1.
Молярная (мольная) масса М (Х) –масса единицы количества вещества Х, т.е. масса одного моля данного вещества (г/моль). Молярная масса М (Х) численно равна его относительной молекулярной массе (Мr).
Эквивалент – это некоторая реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо иным способом эквивалентна одному атому или одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Данное определение предложено Конгрессом ИЮПАК. Однако оно отличается громоздкостью, допускает использование в количественных соотношениях реально не существующих «условных» частиц и, к тому же, страдает неопределенностью: «эквивалент - частица …, которая эквивалентна…»(тавтология!).
Кроме того, при таком определении величина эквивалента вещества становится безразмерной и тождественной фактору эквивалентности.
Более конкретным и лишенным перечисленных недостатков является следующее определение: Эквивалент вещества (Э) – это количество вещества, приходящееся на единицу его валентного химического сродства.
Под валентным химическим сродством (W) понимается произведение валентности (модуля заряда для ионов, числа отданных или принятых электронов в окислительно-восстановительной реакции) частицы (В) на их количество в формуле вещества (n):
W = В· n [безразмерна].
Эталоном эквивалента вещества принят 1 моль атомарного водорода. Расчет эквивалента любого вещества производят по формуле
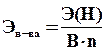 [моль].
[моль].
Безразмерная величина, показывающая, какая часть моля элемента или вещества Х эквивалентна 1 моль атомарного водорода, называется фактором эквивалентности fэ (Х):
 .
.
Масса одного эквивалента (эквивалентная масса) Мэ(Х), г/моль,определяется по формуле
Мэ(Х) = fэ (Х)·М(Х). (1.1)
Если в реакции участвуют газы, то могут быть найдены их эквивалентные объемы Vэ, л/моль, по формуле (при н.у.)
Vэ(Х) = fэ (Х)·22,4 .
Фактор эквивалентности химического элемента Х в его соединениях равен
fэ (Х) = 1:|с.о.| ,
где с.о. – степень окисления элемента Х в данном соединении.
Пример 1.Найти величины факторов эквивалентности и эквивалентных масс для азота в следующих веществах: NН3, НNО3, NО2.
Решение.Для определения фактора эквивалентности химического элемента необходимо определить его степень окисления. Степень окисления – это условный заряд атома элемента в молекуле, рассчитанный исходя из ее электронейтральности и на основе предположения, что молекула состоит из ионов. Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления: водород - +1, кислород –2; но есть исключения. В гидридах активных металлов степень окисления водорода равна –1 (NаН-1), в пероксидах водорода и металлов степень окисления кислорода равна –1 (Н2О2 -1), во фториде кислорода - +2 (О+2F2).
Тогда степень окисления азота в NН3 равна –3, fэ (N) = 1:3,
Мэ(N) =14:3=4,67 г/моль.
Соответственно, для НNО3 степень окисления азота равна +5, fэ (N) = 1:5, Мэ(N) =14:5=2,8 г/моль.
В NО2 степень окисления азота равна +4, fэ (N) = 1:4,
Мэ(N) =14:4=3,6 г/моль.
Дата добавления: 2016-01-09; просмотров: 1531;
